Содержание
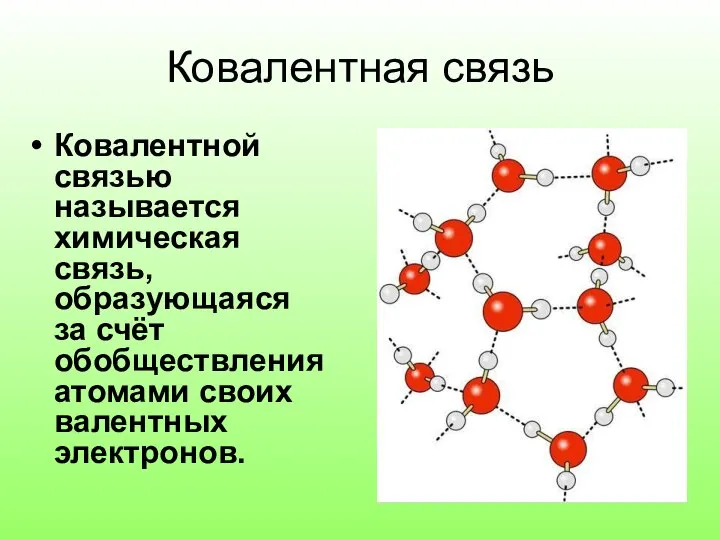
- 2. Ковалентная связь Ковалентной связью называется химическая связь, образующаяся за счёт обобществления атомами своих валентных электронов.
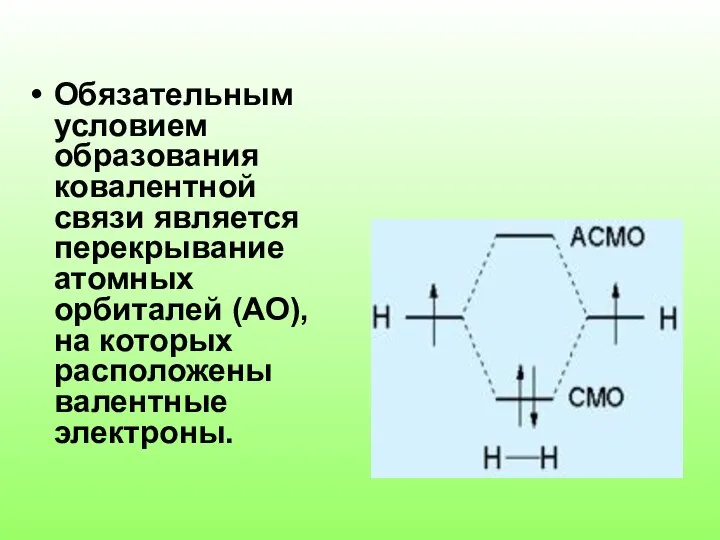
- 3. Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых расположены валентные электроны.
- 4. Химическая связь, возникающая в результате образования общих электронных пар, называется атомной или ковалентной
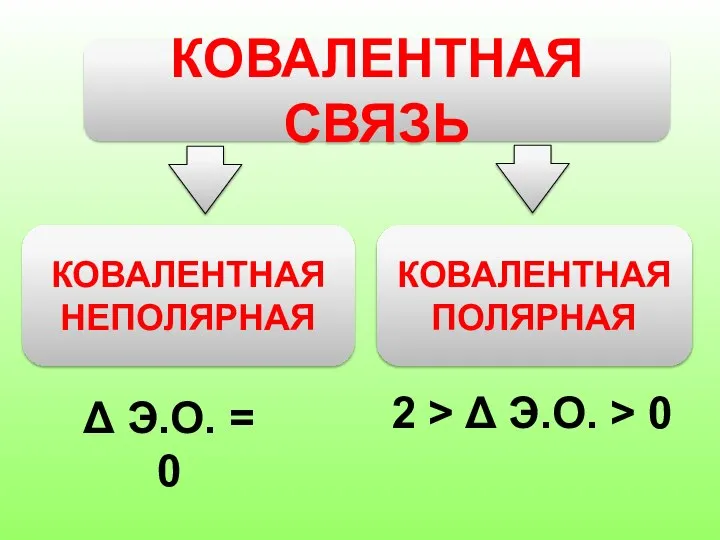
- 5. КОВАЛЕНТНАЯ СВЯЗЬ КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ ПОЛЯРНАЯ Δ Э.О. = 0 2 > Δ Э.О. > 0
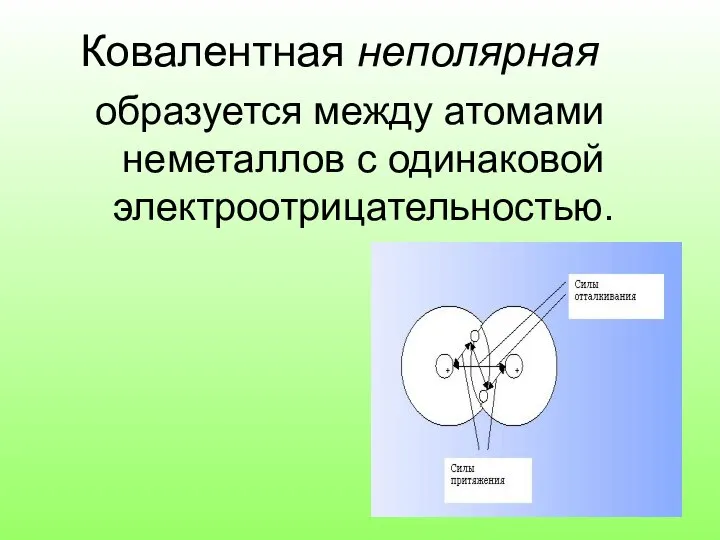
- 6. Ковалентная неполярная образуется между атомами неметаллов с одинаковой электроотрицательностью.
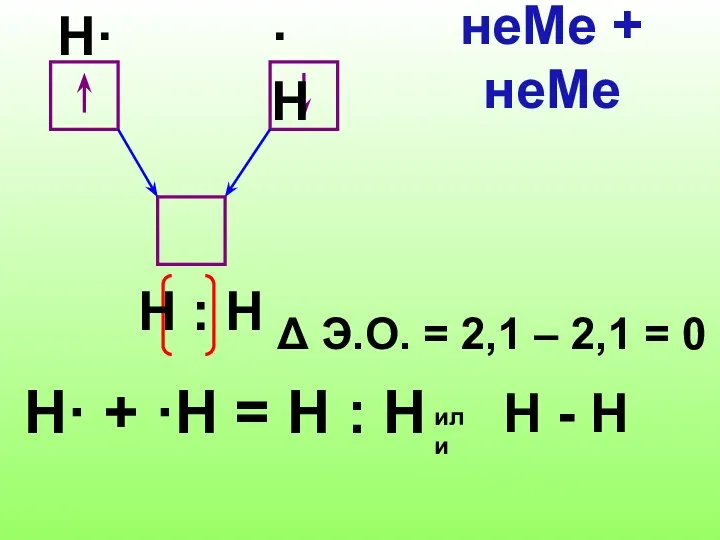
- 7. H· + ·Н = Н : Н Δ Э.О. = 2,1 – 2,1 = 0 неМе
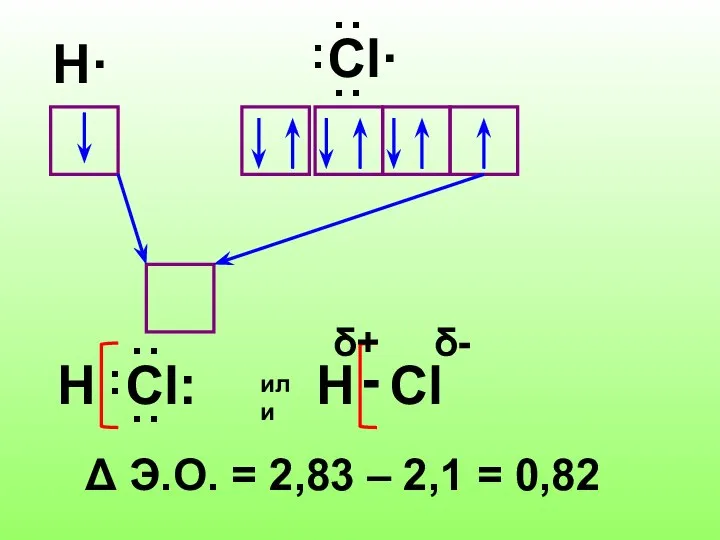
- 8. Ковалентная полярная связь Ковалентная связь между атомами элементов, электроотрицательности которых различаются называют полярной
- 10. H· Δ Э.О. = 2,83 – 2,1 = 0,82
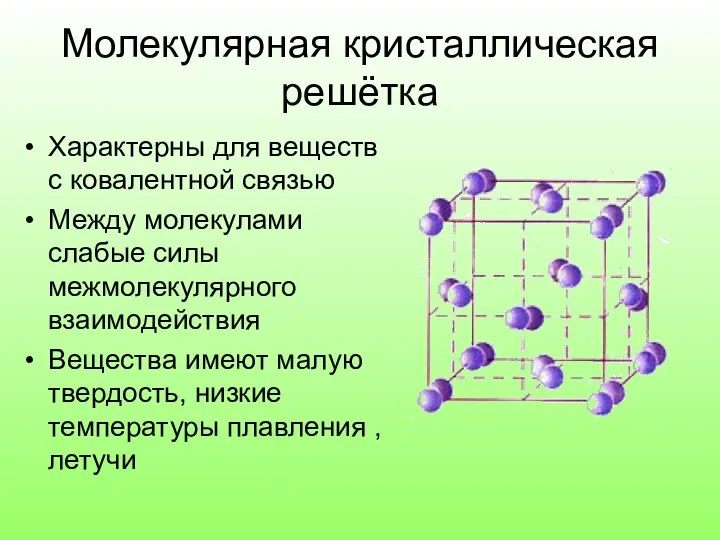
- 11. Молекулярная кристаллическая решётка Характерны для веществ с ковалентной связью Между молекулами слабые силы межмолекулярного взаимодействия Вещества
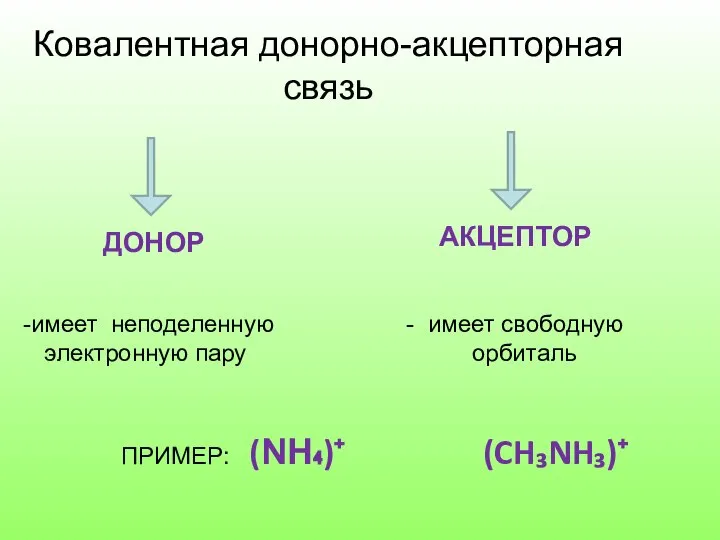
- 12. Ковалентная донорно-акцепторная связь ДОНОР АКЦЕПТОР имеет неподеленную - имеет свободную электронную пару орбиталь ПРИМЕР: (NH₄)⁺ (CH₃NH₃)⁺
- 14. Скачать презентацию



 Классификация, виды бензинов и их свойства
Классификация, виды бензинов и их свойства Углеводы
Углеводы Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Диены. Сопряженные диены
Диены. Сопряженные диены Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Производство геля для душа и его состав
Производство геля для душа и его состав Презентация к уроку « Токсичное воздействие этанола на организм человека» Выполнила учитель химии МАОУ Боровской средней общеоб
Презентация к уроку « Токсичное воздействие этанола на организм человека» Выполнила учитель химии МАОУ Боровской средней общеоб Миф о холоде. Задача 7
Миф о холоде. Задача 7 Химические элементы. Простые и сложные вещества Задачи урока: Познакомиться с понятием химический элемент. Познакомиться с поня
Химические элементы. Простые и сложные вещества Задачи урока: Познакомиться с понятием химический элемент. Познакомиться с поня Кислород
Кислород Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20)
Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20) каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола
Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола Презентация по Химии "Теория химического строения органических веществ" - скачать смотреть
Презентация по Химии "Теория химического строения органических веществ" - скачать смотреть  ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА «ПАЛИТРА СРЕДНЕВЕКОВОГО ХУДОЖНИКА» Автор: Екатерина Буянкина, 5 «А» МОУ СОШ № 9 Руководитель: Анна Вла
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА «ПАЛИТРА СРЕДНЕВЕКОВОГО ХУДОЖНИКА» Автор: Екатерина Буянкина, 5 «А» МОУ СОШ № 9 Руководитель: Анна Вла Гидроксид лития ( LiOH)
Гидроксид лития ( LiOH) Бальзам-ополаскиватель для волос
Бальзам-ополаскиватель для волос Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей Расчёт равновесного состава
Расчёт равновесного состава Органическая химия. Жиры
Органическая химия. Жиры Химия
Химия Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Урок № 11 Углекислый газ Цель урока: Систематизировать знания о физических свойствах углекислого газа. Повторить понятия «
Урок № 11 Углекислый газ Цель урока: Систематизировать знания о физических свойствах углекислого газа. Повторить понятия « Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК) Кислородосодержащие органические соединения (2 часть) Муравьева Н.А. – учитель химии МОУ «Арбузовская сош»
Кислородосодержащие органические соединения (2 часть) Муравьева Н.А. – учитель химии МОУ «Арбузовская сош»  Процессы растворения твёрдых веществ
Процессы растворения твёрдых веществ Кислоты и основания
Кислоты и основания Решение задач, усложненных данными о растворах(смесях) реагирующих веществ
Решение задач, усложненных данными о растворах(смесях) реагирующих веществ