Содержание
- 2. Механизмы образования связи Cвязь между атомами возникает при перекрывании их атомных орбиталей с образованием молекулярных орбиталей
- 3. ОБМЕННЫЙ МЕХАНИЗМ 04.03.2016 в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в
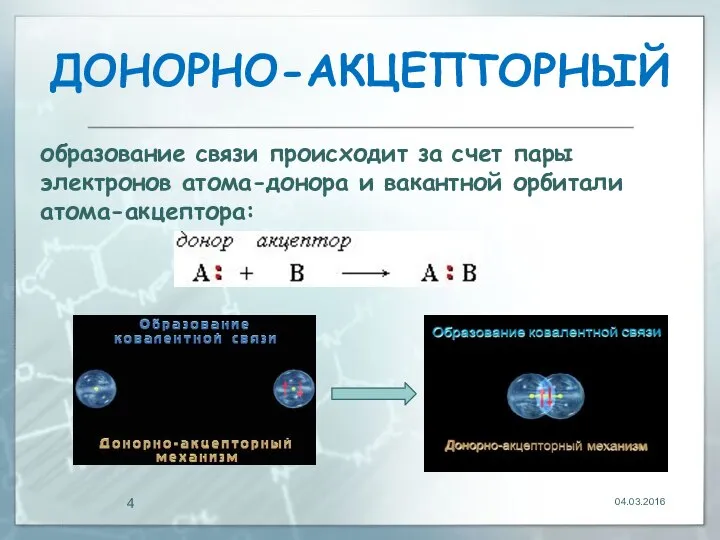
- 4. ДOНОРНО-АКЦЕПТОРНЫЙ 04.03.2016 образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора:
- 5. Донорно-акцепторные связи Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т.е. по донорно-акцепторному механизму,
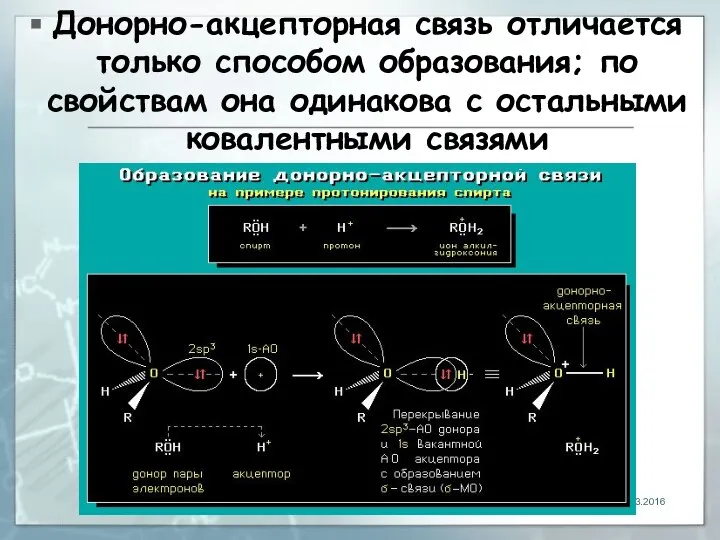
- 6. Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями 04.03.2016
- 7. Сeмипoлярная связь разновидность донорно-акцепторной. Образование происходит при взаимодействии атома-донора пары электронов и атома-акцептора, не имеющих формальных
- 8. Кратные связи образуются при обобществлении двумя атомами более чем одной пары электронов: Н2С : : СН2;
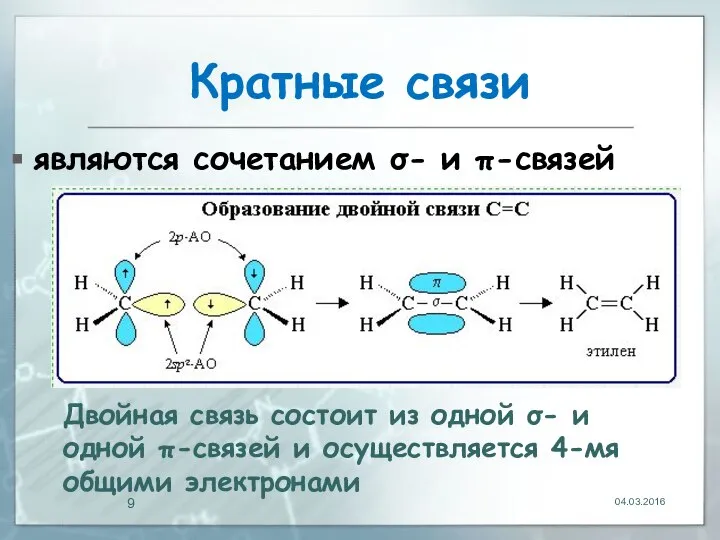
- 9. Кратные связи являются сочетанием σ- и π-связей 04.03.2016 Двойная связь состоит из одной σ- и одной
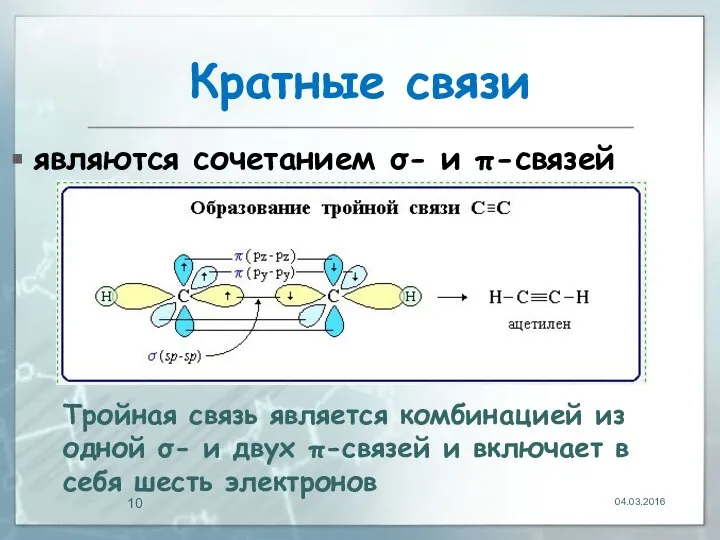
- 10. Кратные связи являются сочетанием σ- и π-связей 04.03.2016 Тройная связь является комбинацией из одной σ- и
- 11. Кратные связи Число электронных пар, участвующих в образовании ковалентной связи называется порядком связи. порядок простой связи
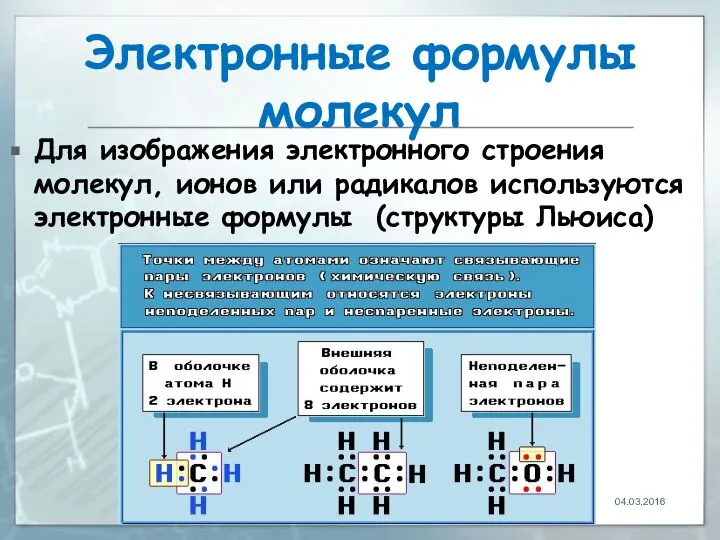
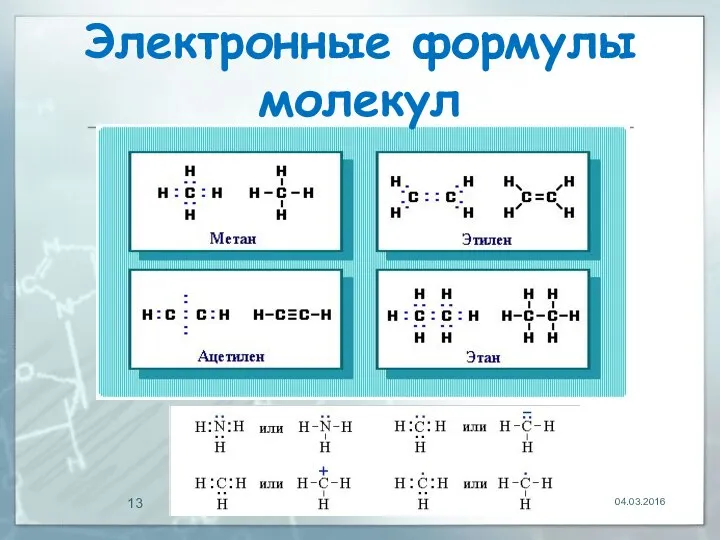
- 12. Электронные формулы молекул Для изображения электронного строения молекул, ионов или радикалов используются электронные формулы (структуры Льюиса)
- 13. 04.03.2016 Электронные формулы молекул
- 14. Атомно-орбитальные модели взаимное расположение атомных орбиталей разного типа: участвующих в образовании ковалентных связей; с неспаренным электроном;
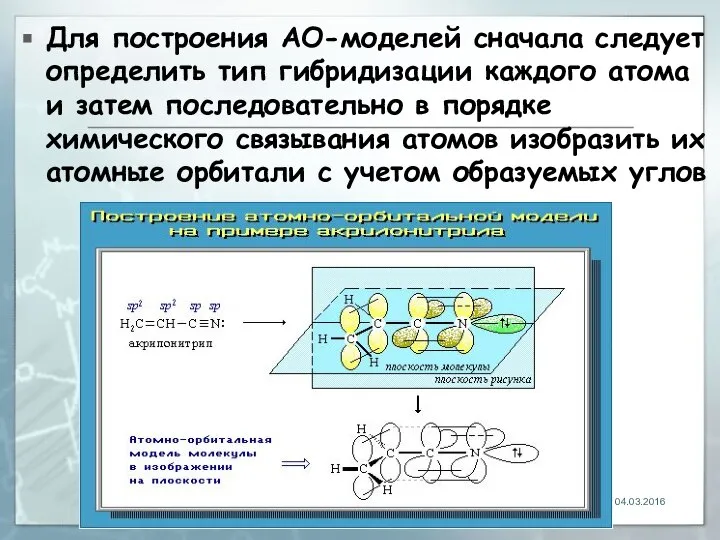
- 15. Для построения АО-моделей сначала следует определить тип гибридизации каждого атома и затем последовательно в порядке химического
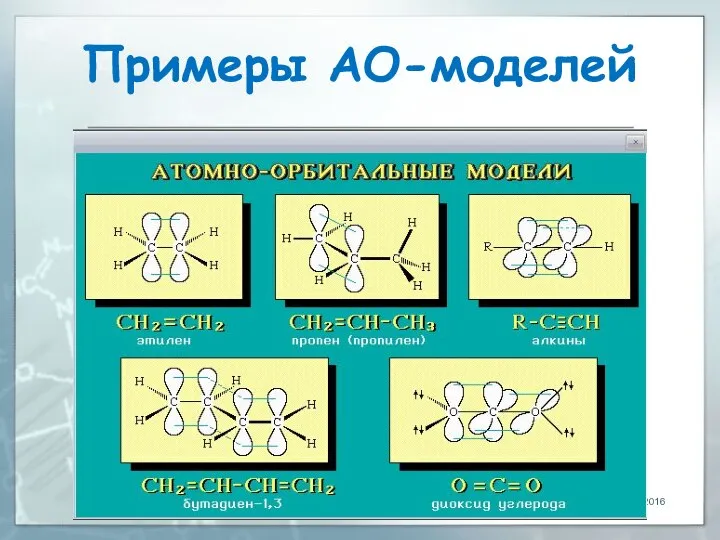
- 16. Примеры АО-моделей 04.03.2016
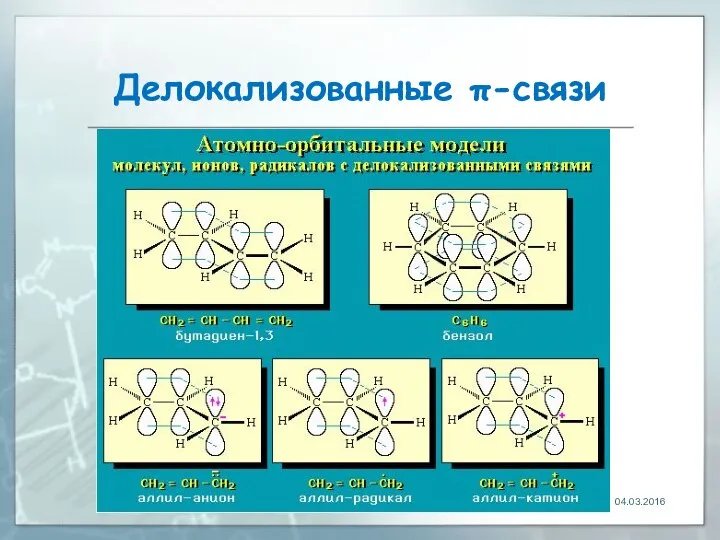
- 17. Делокализованные π-связи. Сопряжение связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов 04.03.2016
- 18. Делокализованные π-связи Рассредоточение электронов - энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы 04.03.2016
- 19. Делокализованные π-связи 04.03.2016
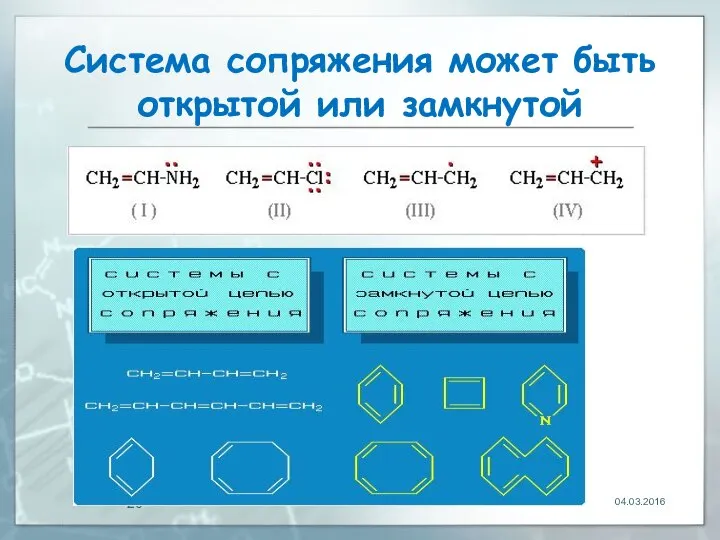
- 20. Система сопряжeния может быть открытой или замкнутой 04.03.2016
- 21. Бензол 04.03.2016
- 22. Водородные связи (Н-связи) Атом водорода, связанный с электро-отрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток
- 23. Водородные связи (Н-связи) Эта связь значительно слабее других химических связей (энергия ее образования 10-40 кДж/моль) и
- 24. Образование водородных связей В молекуле спирта R-O-H химическая связь между атомом водорода и более электроотрицательным атомом
- 25. Образование водородных связей Следовательно, возможно образование водородных связей между молекулами спирта: 04.03.2016
- 26. Образование водородных связей Это приводит к ассоциации молекул и объясняет относительно высокую т.кип. спиртов: 04.03.2016
- 27. Образование водородных связей В присутствии воды возникают водородные связи между молекулами спирта и воды: 04.03.2016
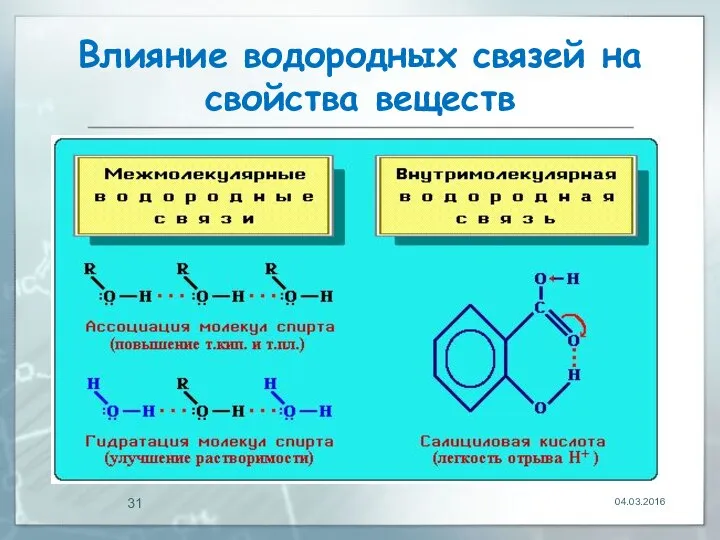
- 28. Влияние водородных связей на свойства веществ Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению
- 29. Влияние водородных связей на свойства веществ Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый
- 30. Влияние водородных связей на свойства веществ Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле
- 31. Влияние водородных связей на свойства веществ 04.03.2016
- 32. 1.Контрольная работа 04.03.2016
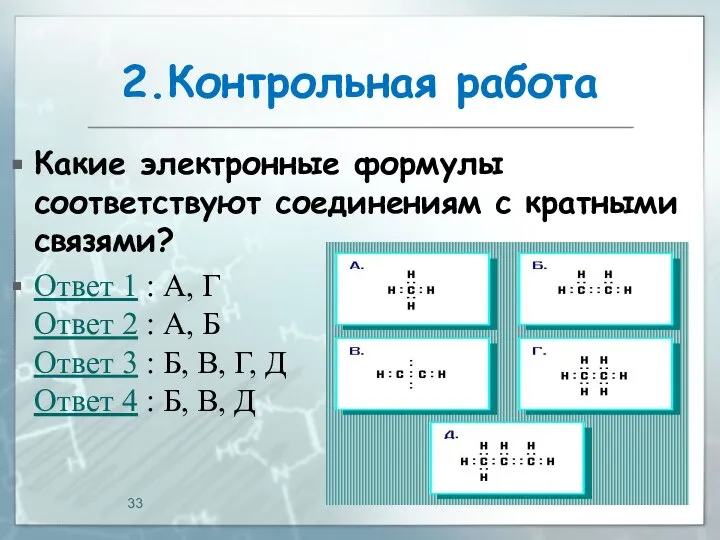
- 33. 2.Контрольная работа Какие электронные формулы соответствуют соединениям с кратными связями? Ответ 1 : А, Г Ответ
- 34. 3.Контрольная работа В каких молекулах имеются делокализованные p-связи? а) CH2=CH-CH2-CH=CH2 б) CH2=CH-CH=CH2 в) CH2=CH2 Ответ 1
- 35. 4.Контрольная работа Укажите соединения, в которых есть атомы водорода, способные к образованию водородной связи: а) CH3-O-CH3
- 36. 5.Контрольная работа 04.03.2016
- 37. 6.Контрольная работа 04.03.2016
- 38. 7.Контрольная работа 04.03.2016
- 39. 8.Контрольная работа 04.03.2016
- 41. Скачать презентацию


























 Синтез 2,6-диметил-3,5-диэтоксикарбонилпиридина
Синтез 2,6-диметил-3,5-диэтоксикарбонилпиридина Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом
Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом История развития химии
История развития химии Презентация по Химии "Алгоритм решения задач" - скачать смотреть
Презентация по Химии "Алгоритм решения задач" - скачать смотреть  Ленточные силикаты
Ленточные силикаты Отримання кисню. Властивості кисню
Отримання кисню. Властивості кисню Термодинамика. Химическое равновесие. Кинетика
Термодинамика. Химическое равновесие. Кинетика Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Презентация по Химии "Полимеры" 10 класс
Презентация по Химии "Полимеры" 10 класс Термические процессы нефтепереработки
Термические процессы нефтепереработки Задачи на массовую долю растворённого вещества в растворе
Задачи на массовую долю растворённого вещества в растворе Отравляющие вещества
Отравляющие вещества  Особенности химического состава клетки
Особенности химического состава клетки Adaptive response of metal-oxide memristive nanostructures to periodic electric stimulation
Adaptive response of metal-oxide memristive nanostructures to periodic electric stimulation Композиционные или композитные материалы
Композиционные или композитные материалы Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Ионный обмен или сорбция
Ионный обмен или сорбция Термодинамическое равновесие
Термодинамическое равновесие Аморфные сплавы
Аморфные сплавы Классификация моторных масел
Классификация моторных масел Комплексные соединения
Комплексные соединения Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Подготовка к аттестации. ГОУ гимназия №1587ЮАО, Иванова Т.Ю.
Подготовка к аттестации. ГОУ гимназия №1587ЮАО, Иванова Т.Ю. Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)
Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)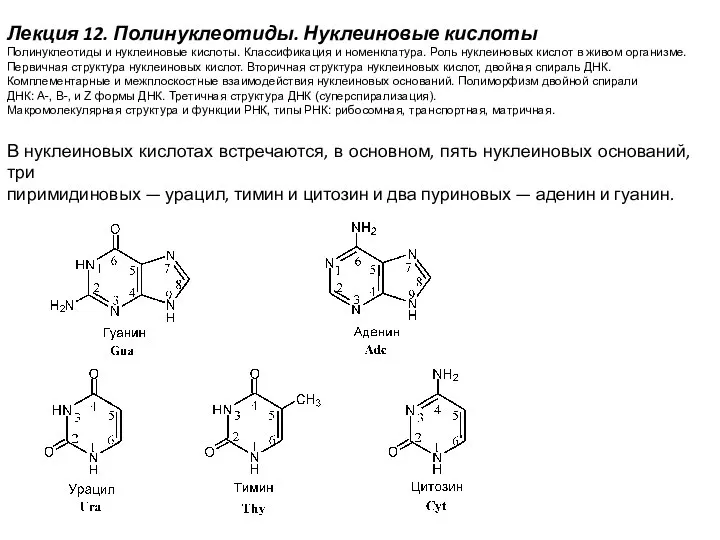 Полинуклеотиды. Нуклеиновые кислоты
Полинуклеотиды. Нуклеиновые кислоты Противогололёдные реагенты. Вред или польза?
Противогололёдные реагенты. Вред или польза? Структура ЕГЭ по химии. Электролиз
Структура ЕГЭ по химии. Электролиз