Содержание
- 2. План лекции: Типы генетической рекомбинации. Общая (гомологичная) рекомбинация. Разрыв и воссоединение нитей ДНК. Ассимиляция нитей. Образование
- 3. Типы рекомбинации Рекомбинация – возникновение новых последовательностей ДНК за счёт разрывов и перевоссоединения предшествующих молекул Рекомбинация
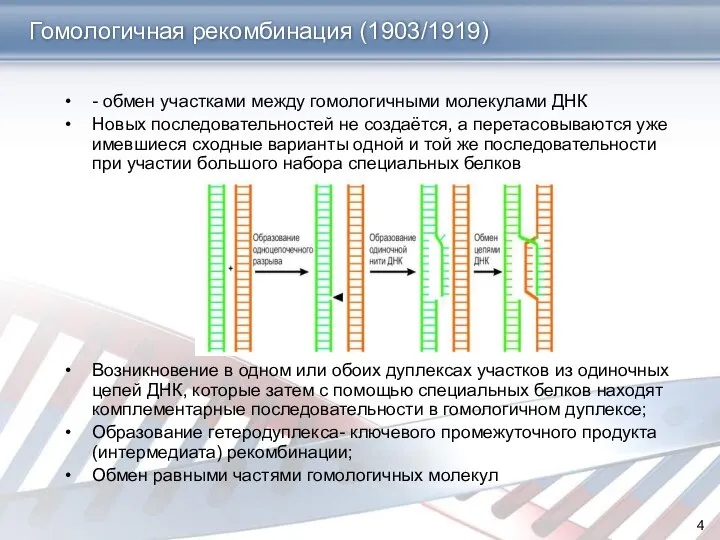
- 4. Гомологичная рекомбинация (1903/1919) - обмен участками между гомологичными молекулами ДНК Новых последовательностей не создаётся, а перетасовываются
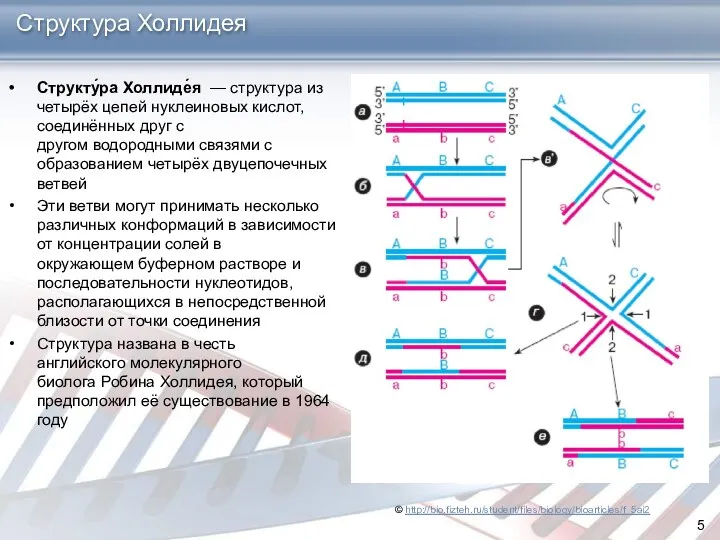
- 5. Структура Холлидея Структу́ра Холлиде́я — структура из четырёх цепей нуклеиновых кислот, соединённых друг с другом водородными
- 6. Структура Холлидея Робин Холлидей (1932—2014) предположил структуру соединения, как часть своей модели гомологичной рекомбинации, разработанной на
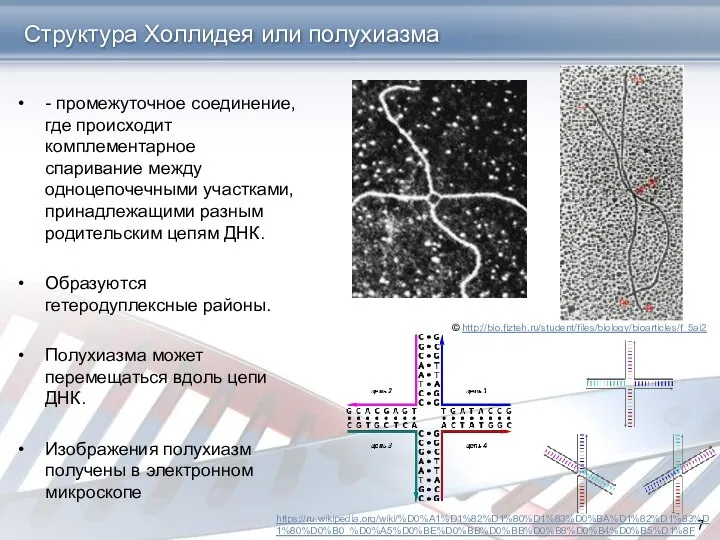
- 7. Структура Холлидея или полухиазма - промежуточное соединение, где происходит комплементарное спаривание между одноцепочечными участками, принадлежащими разным
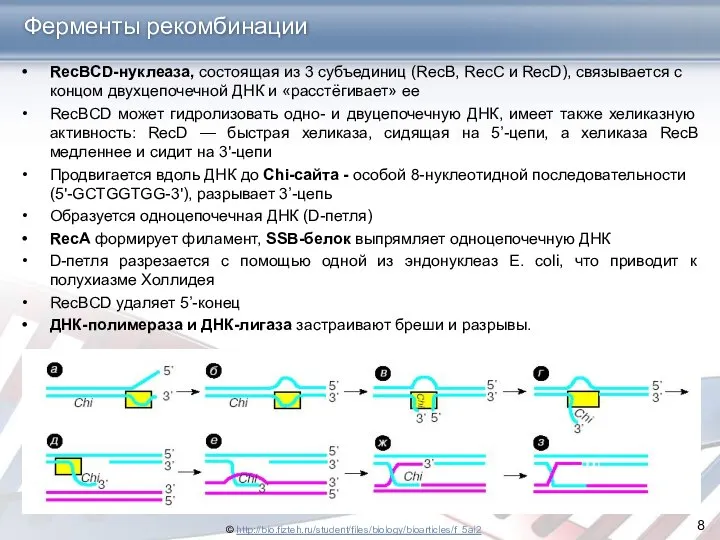
- 8. Ферменты рекомбинации RecBCD-нуклеаза, состоящая из 3 субъединиц (RecB, RecC и RecD), связывается с концом двухцепочечной ДНК
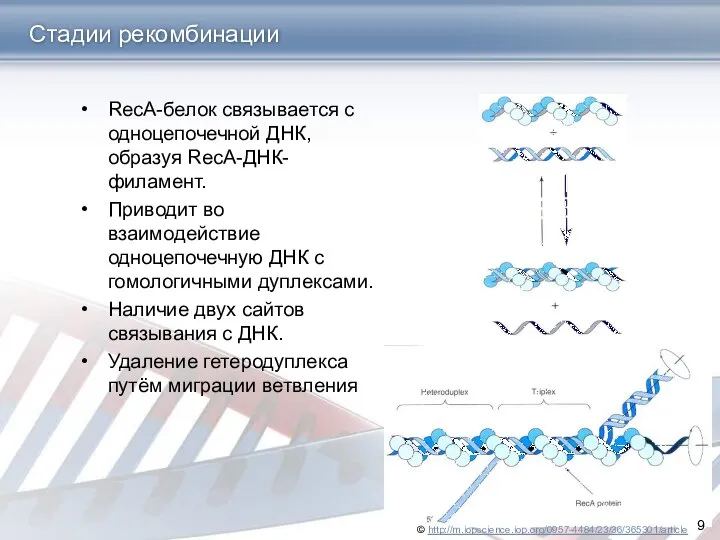
- 9. Стадии рекомбинации RecA-белок связывается с одноцепочечной ДНК, образуя RecA-ДНК-филамент. Приводит во взаимодействие одноцепочечную ДНК с гомологичными
- 10. Стадии рекомбинации Последующие этапы - миграцию ветвления и разрешение полухиазмы осуществляют белки: RuvA, RuvB и RuvC
- 11. Стадии рекомбинации http://www.blackwellpublishing.com/trun/artwork/Animations/Recombination/recombination.html
- 12. Сайт-специфическая рекомбинация бактериофага λ Происходит между специфическими сегментами дуплексов ДНК, не имеющими протяженных гомологичных участков. Фермент
- 13. Рекомбинация происходит в пределах специфической нуклеотидной последовательности ДНК фага λ (attP-сайт) и уникальной последовательности ДНК Е.
- 14. - рекомбинация между негомологичными нуклеотидными последовательностями происходит в клетках прокариот и дрожжей достаточно редко, а в
- 16. Скачать презентацию







 Вспомогательные устройства для высокоэффективной жидкостной хроматографии (ВЭЖХ)
Вспомогательные устройства для высокоэффективной жидкостной хроматографии (ВЭЖХ) Композиционные материалы, состав и классификация композиционных материалов
Композиционные материалы, состав и классификация композиционных материалов Степень окисления
Степень окисления Алканы. Гомологический ряд
Алканы. Гомологический ряд Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Класса неорганических соединений.
Класса неорганических соединений. Тұздар гидролизі
Тұздар гидролизі Теоретические основы органической химии
Теоретические основы органической химии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Комплексные соединения
Комплексные соединения Благородные металлы
Благородные металлы КАЛЬЦИЙ Ca 9 класс
КАЛЬЦИЙ Ca 9 класс Неметаллы IVA и IIIA групп Углерод, кремний , бор
Неметаллы IVA и IIIA групп Углерод, кремний , бор Гидролиз солей.
Гидролиз солей.  Спирт µндіру технологиясы
Спирт µндіру технологиясы Колообіг Карбону в природі Оленченко Катерина, 11-Б
Колообіг Карбону в природі Оленченко Катерина, 11-Б  Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химия и экология
Химия и экология Дезактивація радіаційних речовин у зоні ядерного ураження
Дезактивація радіаційних речовин у зоні ядерного ураження Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама
Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate Диаграмма состояния Fe - FeC. Лекция 5 - 6
Диаграмма состояния Fe - FeC. Лекция 5 - 6 Адсорбционные явления. Общая характеристика адсорбции
Адсорбционные явления. Общая характеристика адсорбции Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций
Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Волокна
Волокна Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния