Содержание
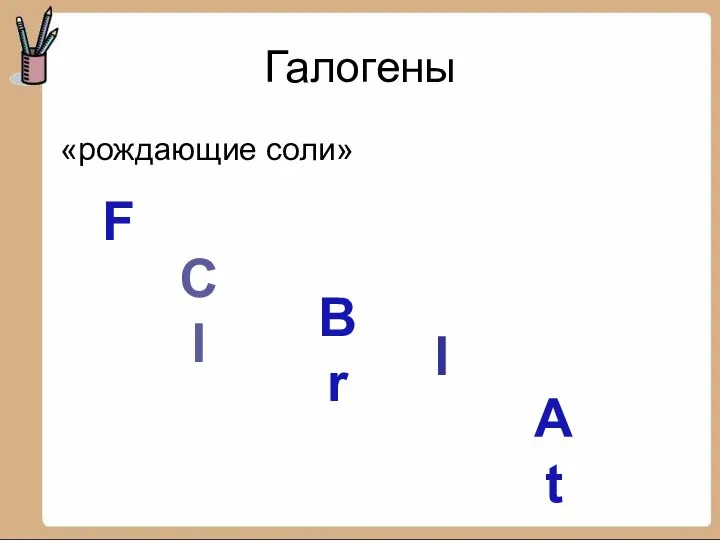
- 2. Галогены «рождающие соли» F CI Br I At
- 3. Распространенность галогенов в природе
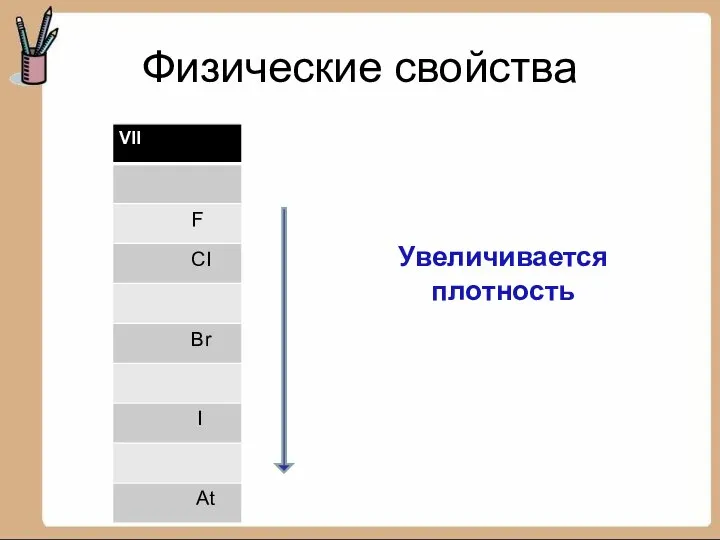
- 4. Физические свойства Увеличивается плотность
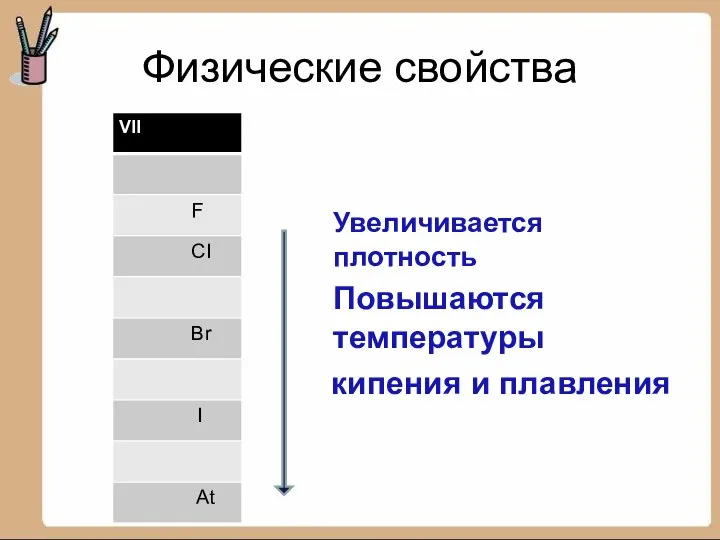
- 5. Физические свойства Увеличивается плотность Повышаются температуры кипения и плавления
- 6. Физические свойства Увеличивается плотность Повышаются температуры кипения и плавления Усиливается интенсивность окраски
- 7. Фтор F2 Ядовитый газ светло-зелёного цвета
- 8. Хлор CI2 - Ядовитый газ жёлто-зеленого цвета
- 9. Бром Br2 Токсичная тяжёлая жидкость красно- бурого цвета
- 10. йод I2 – Твёрдое кристаллическое вещество с металлическим блеском При нагревании образует пары фиолетового цвета
- 11. Ответьте на вопросы. Число электронов на внешнем энергетическом уровне атома; Изменение радиуса атомов и окислительно-восстановительных свойств
- 12. Проверка: На внешнем энергетическом уровне галогены содержат 7 электронов. В главной подгруппе с увеличением зарядов ядер,
- 13. Химические свойства F) ) 2 7 Г°+1ē = Г¯ Галогены- окислители
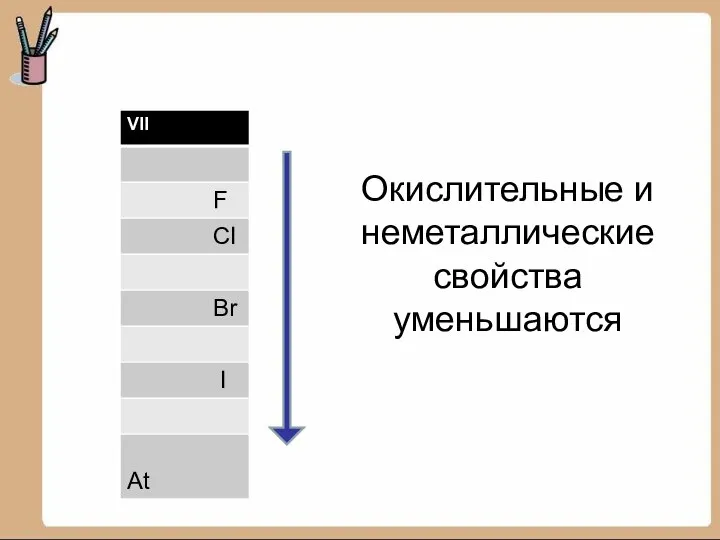
- 14. Окислительные и неметаллические свойства уменьшаются
- 15. Более активный галоген вытесняет менее активный из его соединений с металлами и водородом 2KI + Br2
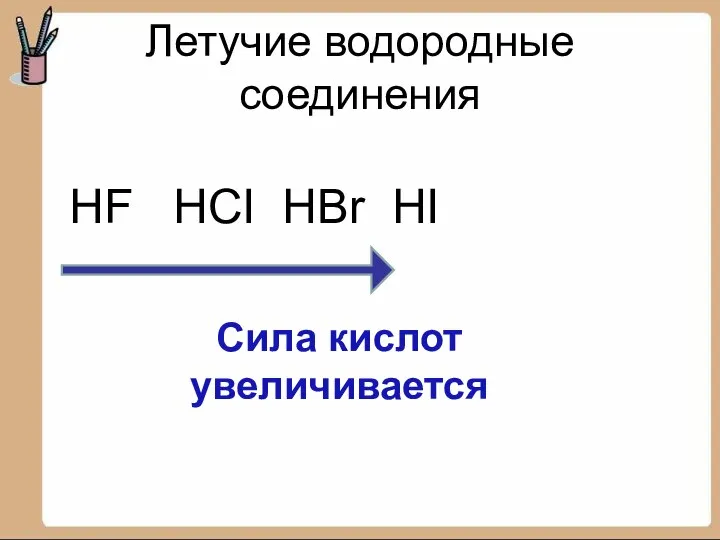
- 16. Летучие водородные соединения HF HCI HBr HI Сила кислот увеличивается
- 17. Вопросы и задания Перечислите галогены. Фтор, хлор, бром, йод, астат. Где в ПСХЭ располагаются галогены? в
- 18. Сопоставьте: Хлор Бром Йод Фтор красно – бурая жидкость светло – зеленый газ жёлто – зелёный
- 20. Скачать презентацию












 Аттестационная работа. Программа регионального компонента образовательной области Химия
Аттестационная работа. Программа регионального компонента образовательной области Химия Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15
Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15 Качественный и количественный анализ бромокриптина и его производных
Качественный и количественный анализ бромокриптина и его производных Органическая химия: «Жиры»
Органическая химия: «Жиры» Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Гетерофункционалды органикалық қосылыстар
Гетерофункционалды органикалық қосылыстар Аттестационная работа. Программа элективного курса «Химия в задачах»
Аттестационная работа. Программа элективного курса «Химия в задачах» Серная кислота
Серная кислота Кислород. Получение кислорода и его физические свойства урок-презентация по химии 8 класс учитель: Видершпан И.П.
Кислород. Получение кислорода и его физические свойства урок-презентация по химии 8 класс учитель: Видершпан И.П. Кремний и его соединения
Кремний и его соединения Лекция 9. Реакции нуклеофильного замещения(Sn) в ряду карбоновых кислот
Лекция 9. Реакции нуклеофильного замещения(Sn) в ряду карбоновых кислот Презентация Угарный газ
Презентация Угарный газ  Предмет органической химии. Теория химического строения органических
Предмет органической химии. Теория химического строения органических Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза
Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Алкадиены (диены)
Алкадиены (диены) Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Повторение и обобщение знаний по темам "Металлы и сплавы."
Повторение и обобщение знаний по темам "Металлы и сплавы." Презентация по Химии "Кто хочет стать отличником" - скачать смотреть
Презентация по Химии "Кто хочет стать отличником" - скачать смотреть  Моноядерні арени
Моноядерні арени Проект «Волшебство химии»
Проект «Волшебство химии» Химия өнеркәсібіндегі энергетикалық ресурстар
Химия өнеркәсібіндегі энергетикалық ресурстар Вода. Растворы. Растворение
Вода. Растворы. Растворение Основные понятия и законы химии
Основные понятия и законы химии Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Расчёты по уравнению реакции
Расчёты по уравнению реакции Дисперсные
Дисперсные  Комбинированные задачи. 11 класс. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Комбинированные задачи. 11 класс. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.