Содержание
- 2. 2 семестр. Органическая химия Всего – 15 лекций Вводный концентр - 2 лекции Основные типы углеводородных
- 3. Литература В.Ф. Травень. "Органическая химия: учебник для вузов" в 2 т., М: ИКЦ Академкнига, 2008. И.И.
- 4. «ЛИНКАТУРА» Dropbox® (для студентов) www.chem.msu.ru/rus/teaching/org.html Физтех, 1 курс. Весна 2016
- 5. Возникновение «Органической химии» 1806 «Органическая химия – химия соединений углерода» (Берцелиус) 1853 «Органическая химия занимается изучением
- 6. Физтех, 1 курс. Весна 2016 Отличия «Органической химии» Известно более 80 000 000 органических соединений –
- 7. Углерод и органические вещества в природе Физтех, 1 курс. Весна 2016 Фазовая диаграмма углерода, заштрихованы области
- 8. Аллотропные формы углерода а - алмаз b - графит c - лонсдейлит d – карбин e
- 9. Этапы развития Органической химии II-XVII век (н.э.): этап накопления и реализации эмпирических знаний XVIII-1828 г.: виталистическая
- 10. Становление классической структурной теории (КСТ) К 1860 году открытия и работы, сделанные за полвека, Берцелиусом, Вёлером,
- 11. «Всякое органическое соединение имеет единственную химическую формулу, отражающую порядок связывания атомов в молекуле и определяющую его
- 12. Физтех, 1 курс. Весна 2016 «Заключения о химическом строении веществ, по всей вероятности, можно всего лучше
- 13. Физтех, 1 курс. Весна 2016 «Если при одинаковом составе вещества отличаются свойствами, то они должны также
- 14. Физтех, 1 курс. Весна 2016 В 1848 г. Луи Пастер, кристаллизуя из водного раствора натриево-аммониевую соль
- 15. Физтех, 1 курс. Весна 2016 Идея специфичности строения таких соединений была развита Якобом Вант-Гоффом (1874-1875) Постулат:
- 16. Постулаты КСТ: Любую молекулу можно представить как совокупность атомов различного вида, соединенных друг с другом в
- 17. Относительная энергия s- и p-орбиталей Принцип запрета Паули - два электрона не могут находиться в одном
- 18. При образовании молекул атомы удовлетворяют свою потребность в достижении 8-электронной валентной оболочки, подобной электронной конфигурации благородных
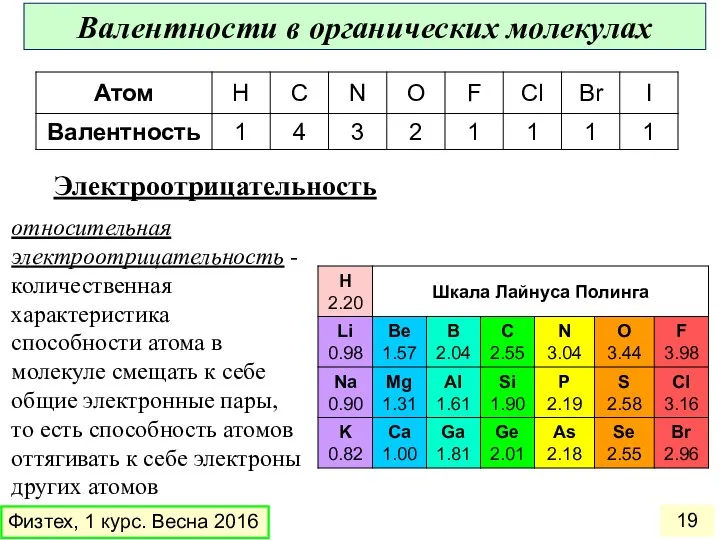
- 19. Электроотрицательность относительная электроотрицательность - количественная характеристика способности атома в молекуле смещать к себе общие электронные пары,
- 20. В органической химии чаще всего встречаются три типа химической связи: ковалентная неполярная: ковалентная полярная: ионная: Применение
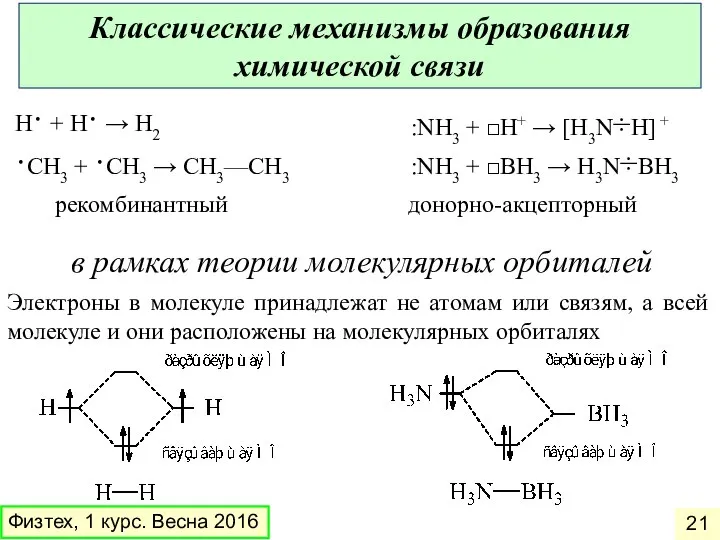
- 21. рекомбинантный донорно-акцепторный H· + H· → H2 ·CH3 + ·CH3 → CH3—CH3 :NH3 + □H+ →
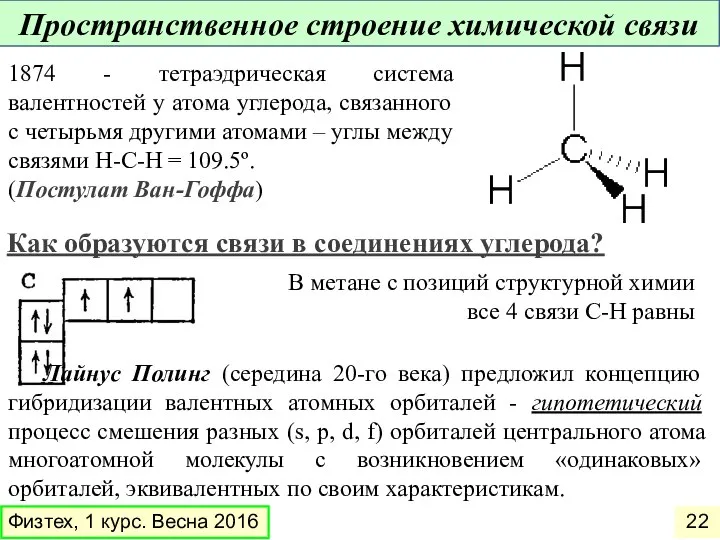
- 22. 1874 - тетраэдрическая система валентностей у атома углерода, связанного с четырьмя другими атомами – углы между
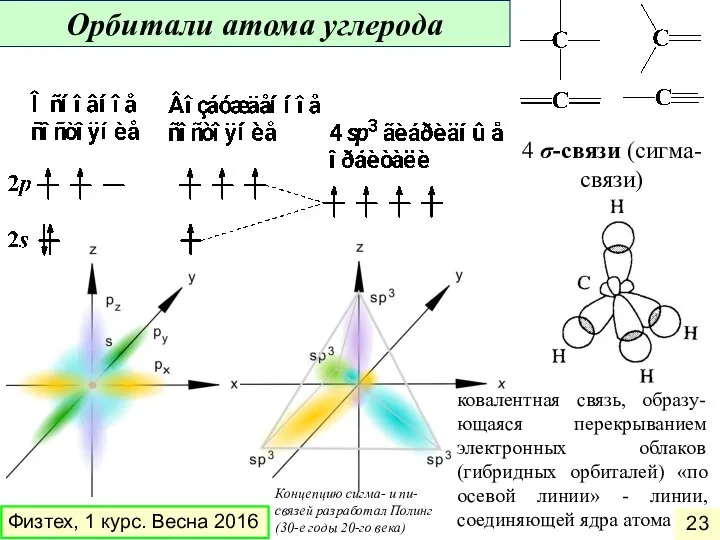
- 23. 4 σ-связи (сигма-связи) ковалентная связь, образу-ющаяся перекрыванием электронных облаков (гибридных орбиталей) «по осевой линии» - линии,
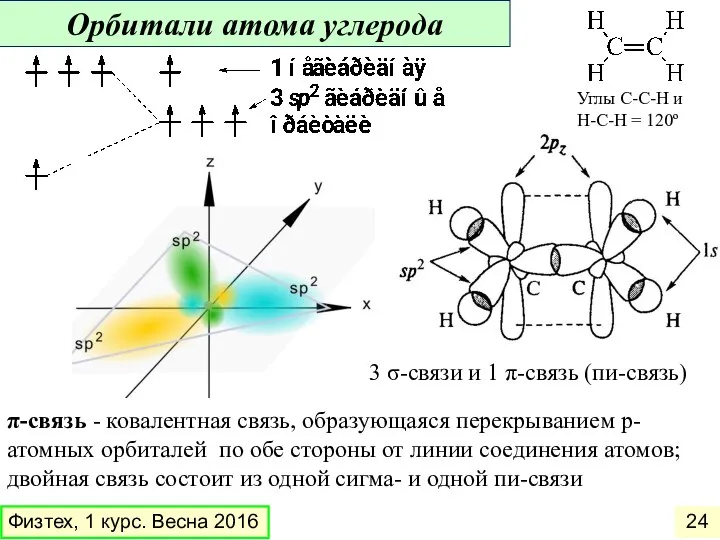
- 24. π-связь - ковалентная связь, образующаяся перекрыванием p-атомных орбиталей по обе стороны от линии соединения атомов; двойная
- 25. Лайнус Полинг – модель изогнутых связей этилен Углы С-С-Н = 180º Орбитали атома углерода Физтех, 1
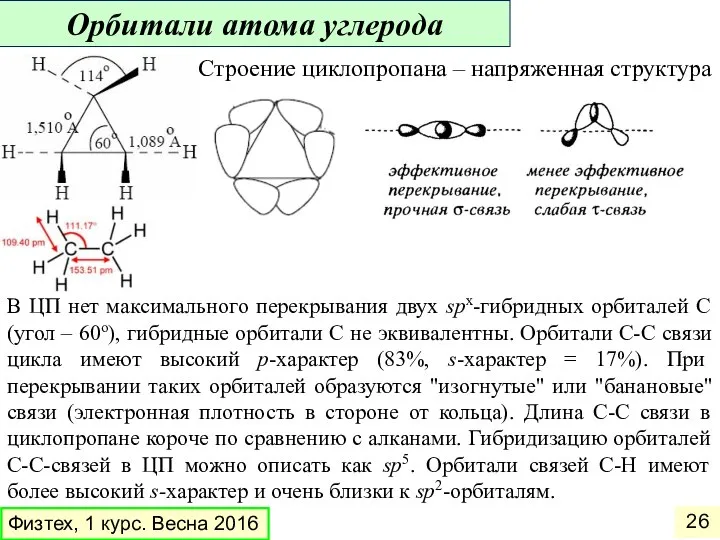
- 26. Строение циклопропана – напряженная структура В ЦП нет максимального перекрывания двух sрx-гибридных орбиталей C (угол –
- 27. График волновой функции p-электрона (имеется перегиб). По одну сторону от ядра Ψ положительна, а по другую
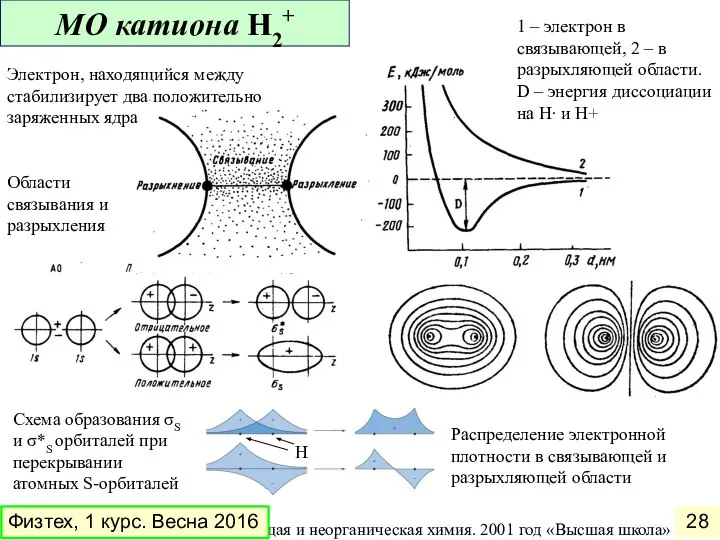
- 28. Рисунки из книги Н.С.Ахметов. Общая и неорганическая химия. 2001 год «Высшая школа» Области связывания и разрыхления
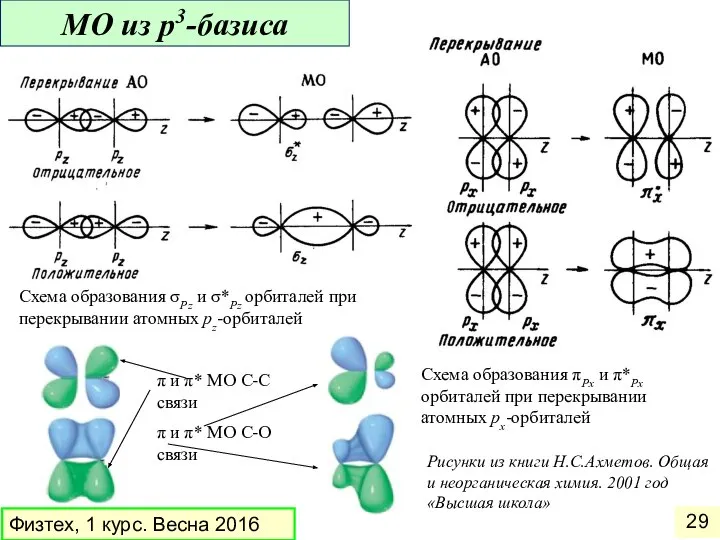
- 29. Рисунки из книги Н.С.Ахметов. Общая и неорганическая химия. 2001 год «Высшая школа» Схема образования σPz и
- 30. Форма гибридной орбитали определяется путем сложения волновых функций исходных орбиталей. В результате сложения волновых функций s-
- 31. Энергия связи - разность между энергией состояния, в котором составляющие части системы бесконечно удалены друг от
- 32. при гетеролитическом разрыве образуются катион и анион; анион - атом, или молекула, электрический заряд которой отрицателен,
- 33. Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов или энергия, требующаяся
- 34. Длина связи (в нанометрах, пикометрах или Ангстремах: 1Å = 0.1 нм = 100 pm) Нδ+ —
- 35. Структурные фрагменты Формулы Кекуле похожи на формулы Льюиса, но связь (образованная двумя электронами) отображается линией (связи
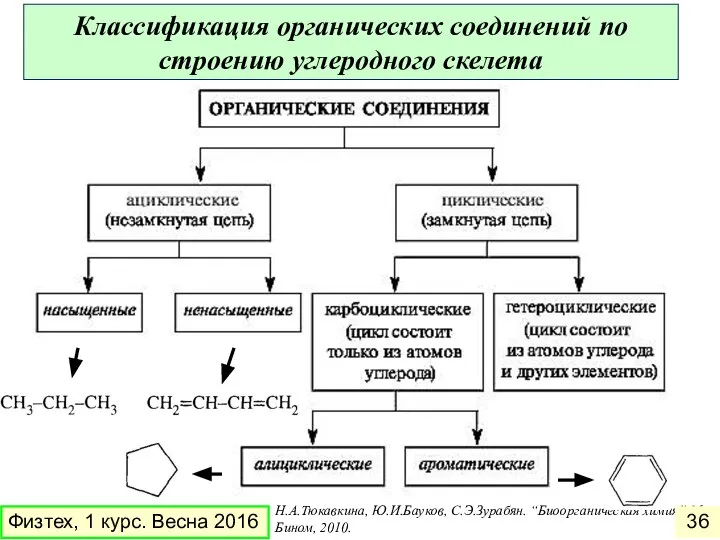
- 36. Н.А.Тюкавкина, Ю.И.Бауков, С.Э.Зурабян. “Биоорганическая химия” М.: Бином, 2010. Классификация органических соединений по строению углеродного скелета Физтех,
- 37. Функциональная группа - это гетероатом или группа атомов неуглеводородного характера, определяющие принадлежность соединения к определенному классу
- 38. По правилам рациональной номенклатуры за основу названия органического соединения принимают название наиболее простого (чаще первого) члена
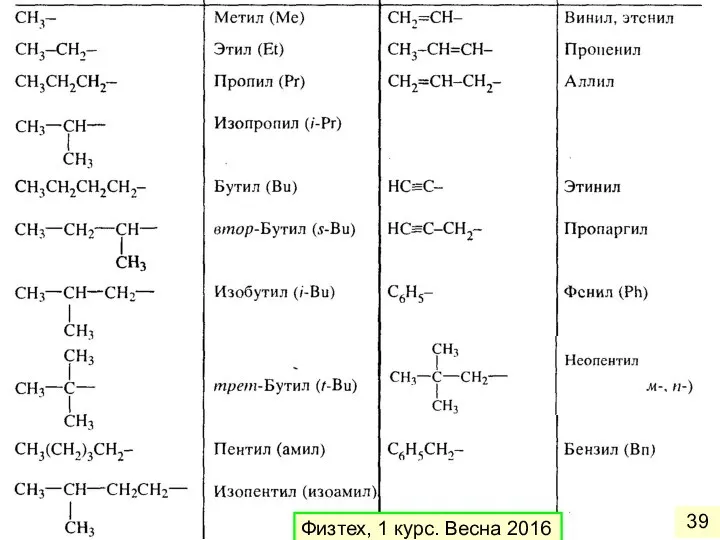
- 39. Физтех, 1 курс. Весна 2016
- 40. Физтех, 1 курс. Весна 2016
- 41. Физтех, 1 курс. Весна 2016
- 42. Правила составления названий 1) выбрать родоначальную структуру; 2) выявить все имеющиеся в соединении функциональные группы; 3)
- 43. В ациклических соединениях главной цепью называют цепь углеродных атомов, составляющую основу названия и нумерации. В состав
- 45. Называя соединение, сначала перечисляют заместители в алфавитном порядке (числительные не принимают во внимание), причем перед названием
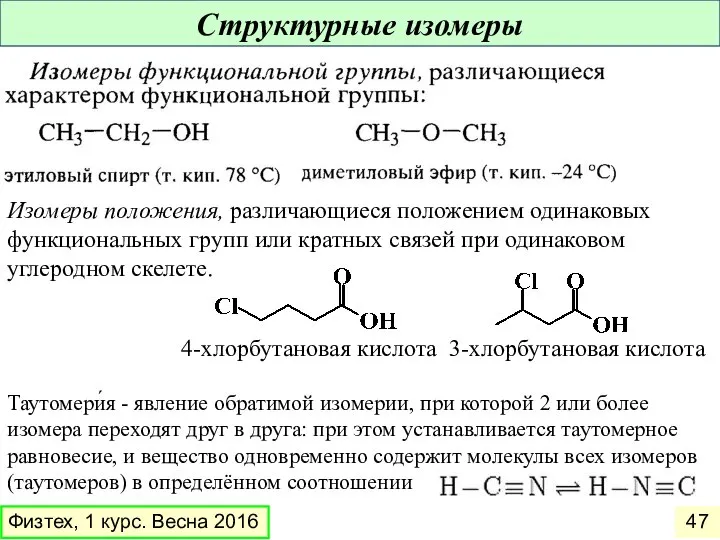
- 46. Виды изомеров Структурные изомеры – вещества, имеющие одинаковую молекулярную, но разную структурную формулу Пространственные изомеры –
- 47. Изомеры положения, различающиеся положением одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. 4-хлорбутановая кислота
- 48. Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Энантиомеры
- 49. Диастереомеры - пространственные изомеры, не являющиеся энантиомерами. σ-диастереомеры: отличаются друг от друга конфигурацией части имеющихся в
- 50. Хиральность Универсальный признак хиральности – отсутствие элементов симметрии в молекуле Хиральность - отсутствие симметрии относительно правой
- 51. (6 плоскостей симметрии , 3 оси симметрии S4) Хиральный объект чаще всего не имеет элементов симметрии.
- 52. Молекулы с одним хиральным центром энантиомеры 4 разных заместителя у атома углерода Энантиомеры различаются знаком угла
- 53. Способы изображения энантиомеров Проекции Фишера Как определить строение конкретного энантиомера - в 1951 году был разработан
- 54. Принцип построения проекции Фишера бромфторхлорметан Расположим молекулу так, чтобы в плоскости чертежа остался только атом С.
- 55. Правила работы с проекциями Фишера НЕЛЬЗЯ: 1) Нельзя выводить проекцию из плоскости чертежа (например, просматривать ее
- 56. R/S-номенклатура Кан, Ингольд, Прелог – наименование абсолютной конфигурации 1. определяем порядок старшинства заместителей при асимметрическом атоме;
- 57. R-изомер Примеры R-конфигурация Физтех, 1 курс. Весна 2016
- 58. Как определить абсолютную конфигурацию по проекции Фишера При изображении соединений с помощью фишеровских проекций можно легко
- 59. D/L-номенклатура Относительная конфигурация стандарт А – старший заместитель по ИЮПАК Физтех, 1 курс. Весна 2016
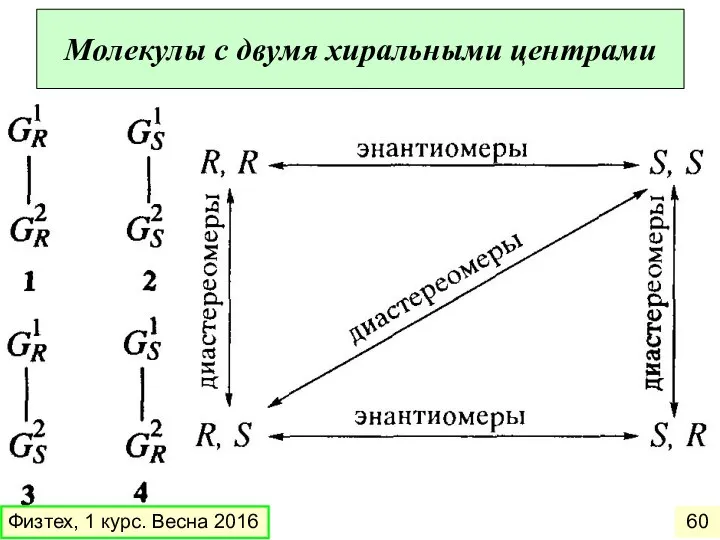
- 60. Молекулы с двумя хиральными центрами Физтех, 1 курс. Весна 2016
- 61. Оптические изомеры соединений с двумя одинаковыми центрами Физтех, 1 курс. Весна 2016
- 62. Вращение групп СН3 в этане относительно связи С-С: требуется энергия ~ 3 ккал/моль Причины возникновения π-диастереомерии
- 63. Конформеры Стереоизомеры в конформациях, соответствующих минимумам потенциальной энергии, называют конформерами (поворотными изомерами) Конформациями называются различные геометрические
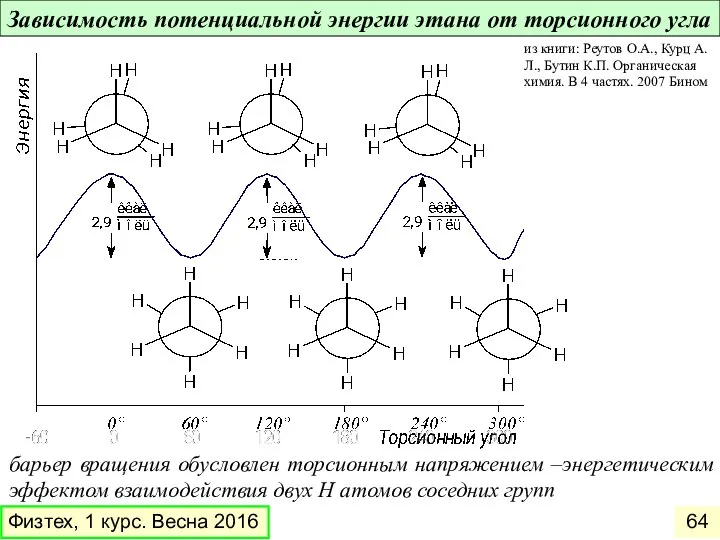
- 64. Зависимость потенциальной энергии этана от торсионного угла барьер вращения обусловлен торсионным напряжением –энергетическим эффектом взаимодействия двух
- 65. Конформации бутана Проекция относительно связи С1-С2: заторможенная конформация заслоненная конформация Физтех, 1 курс. Весна 2016
- 66. Проекция относительно связи С2-С3: А, В, Д – заслоненные конформации в А (заслоненная или цисоидная) появляется
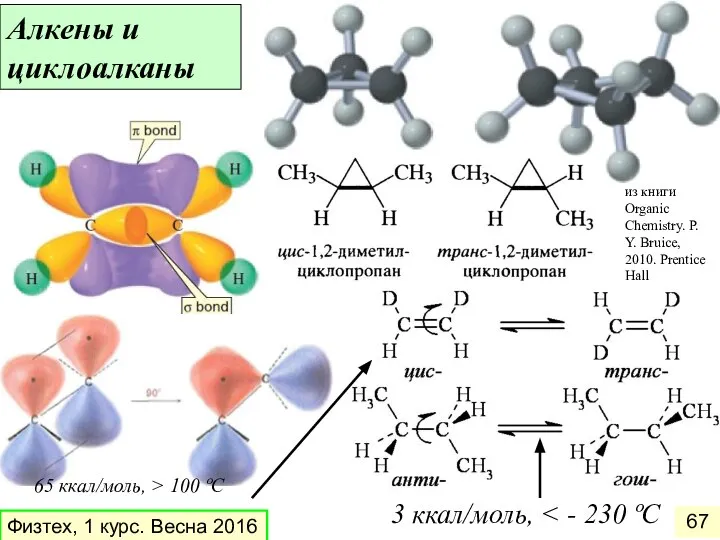
- 67. Алкены и циклоалканы из книги Organic Chemistry. P. Y. Bruice, 2010. Prentice Hall 65 ккал/моль, >
- 68. Электронные эффекты в органических соединениях Электронные эффекты – это смещение электронной плотности в молекуле или другой
- 69. +I-эффект Заместитель при атоме углерода делает полярной связь C-заместитель и вызывает поляризацию нескольких соседних связей, то
- 70. Мезомерный эффект Мезомерный эффект (эффект сопряжения, резонансный эффект) = смещение электронной плотности химической связи по π-связям
- 71. +М-эффект: π-донорные группы: -NR2, -OR, -F, -Cl, -Br, -I (то есть группы, содержащие неподеленную электронную пару
- 72. Основные частицы в органической химии Карбокатионы Атом углерода: плоский, sp2-гибридный; имеет 6 валентных электронов, пустая орбиталь
- 73. Теория резонанса Экспериментальные факты все СС связи в бензоле одинаковы и составляют 1.40 Å (в алканах
- 74. Таким образом, для ряда нейтральных молекул, частиц или ионов молекулярная структура описывается сочетанием (резонансом) всех альтернативных
- 75. Примеры резонансных структур Физтех, 1 курс. Весна 2016
- 76. Ряд стабильности карбокатионов (в газовой фазе) (СF3)3C+ индуктивный эффект мезомерный эффект, резонансная стабилизация Карбокатионы причины стабилизации:
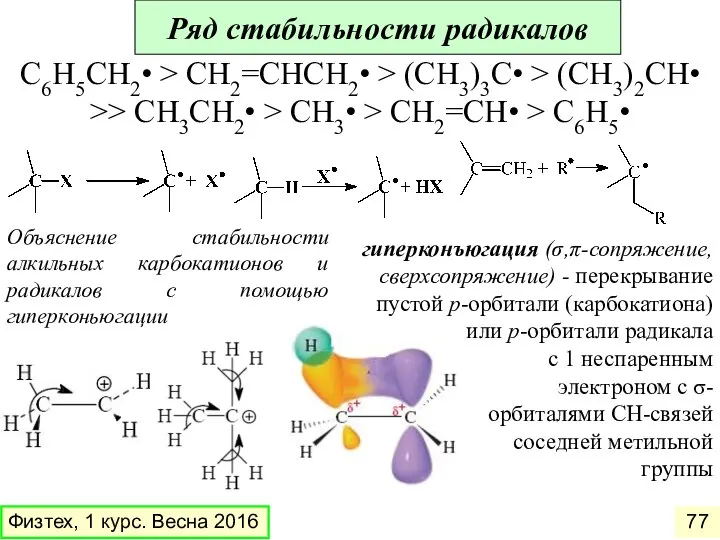
- 77. Ряд стабильности радикалов C6H5CH2• > CH2=CHCH2• > (CH3)3C• > (CH3)2CH• >> CH3CH2• > CH3• > CH2=CH•
- 78. Ряд стабильности карбоанионов (CH3)3С Карбоанионы Причины стабилизации для бензильного и аллильного – сопряжение неподеленной пары аниона
- 79. Основные частицы в органической реакциях Нуклеофилы – электроноизбыточные частицы или молекулы Электрофилы – электронодефицитные частицы или
- 80. Органические реакции В неорганических реакциях участвуют ионы, они проходят быстро и до конца при комнатной температуре.
- 81. Органические реакции: классификация Присоединение Отщепление Замещение Перегруппировка (изомеризация) Физтех, 1 курс. Весна 2016
- 82. Реагенты, отдающие свою пару электронов для образования ковалентной связи в ходе реакции – нуклеофилы Реагенты, принимающие
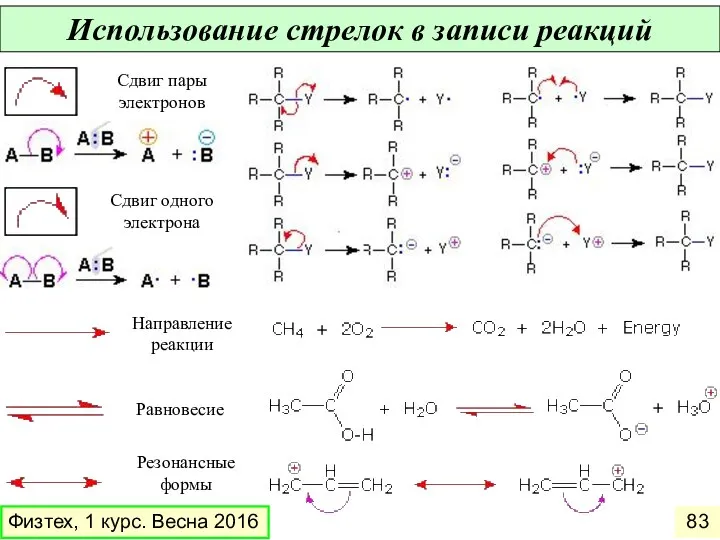
- 83. Использование стрелок в записи реакций Сдвиг пары электронов Сдвиг одного электрона Направление реакции Равновесие Резонансные формы
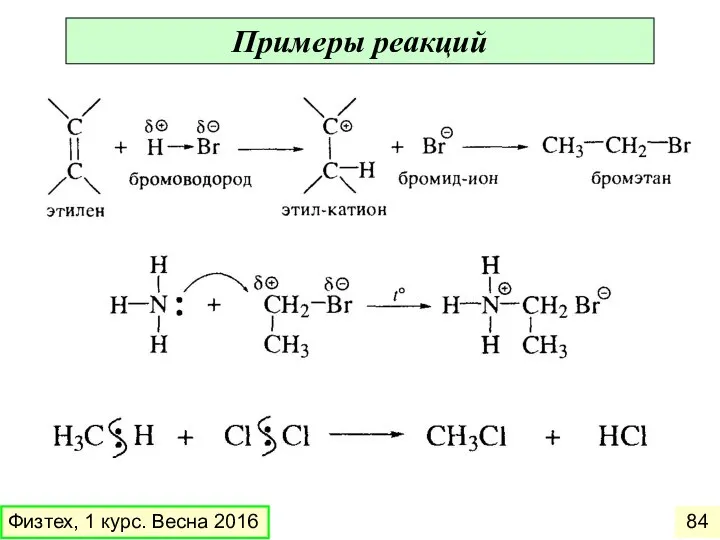
- 84. Примеры реакций Физтех, 1 курс. Весна 2016
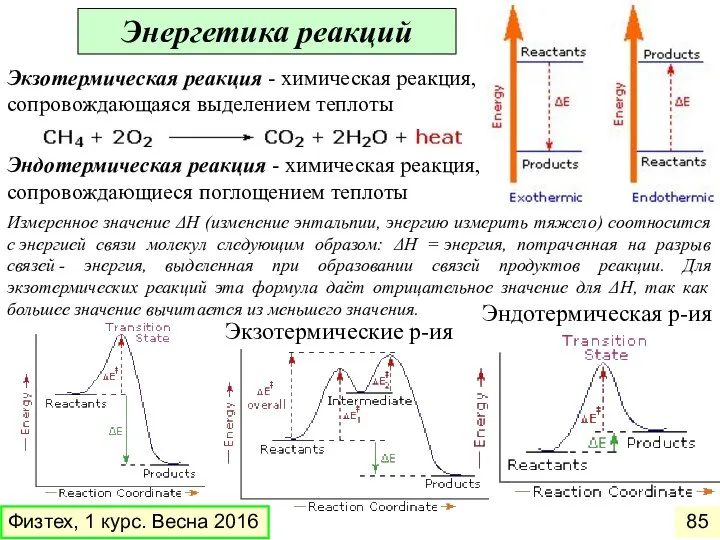
- 85. Энергетика реакций Экзотермическая реакция - химическая реакция, сопровождающаяся выделением теплоты Эндотермическая реакция - химическая реакция, сопровождающиеся
- 86. Основные классы органических соединений Алканы С-С Алкены С=С Диены 2хС=С Алкины С≡С Галогенпроизводные С-Hal Спирты C-OH
- 87. Краткая характеристика основных классов Алканы Брутто-формула: СnH2n+2 Связи: С-Н и С-С -ковалентные неполярные или малополярные Малореакционно-способные
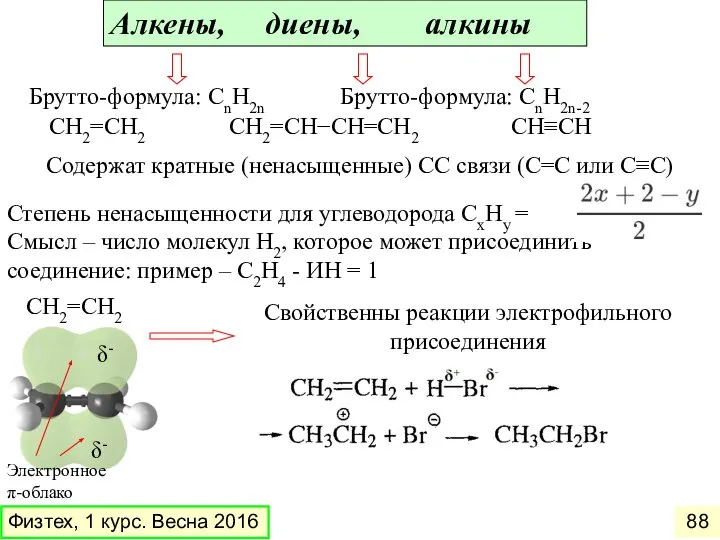
- 88. Алкены, диены, алкины Брутто-формула: СnH2n Брутто-формула: СnH2n-2 СН2=СН2 СН2=СН−СН=СН2 СН≡СН Содержат кратные (ненасыщенные) СС связи (С=С
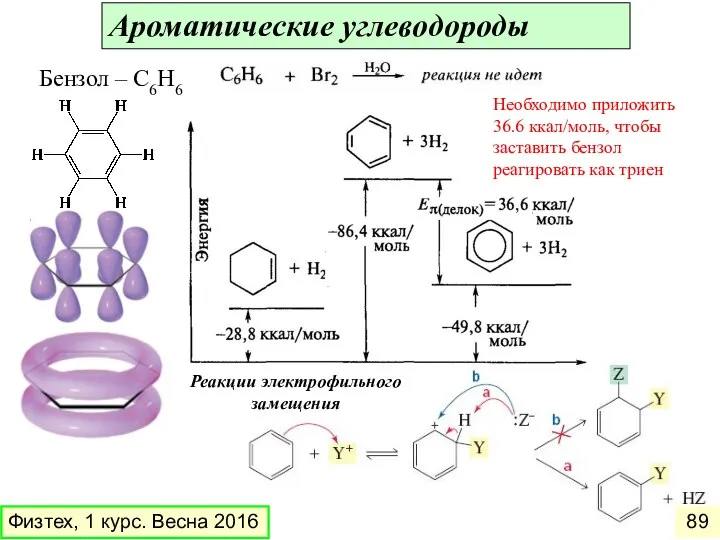
- 89. Ароматические углеводороды Бензол – С6Н6 Необходимо приложить 36.6 ккал/моль, чтобы заставить бензол реагировать как триен Реакции
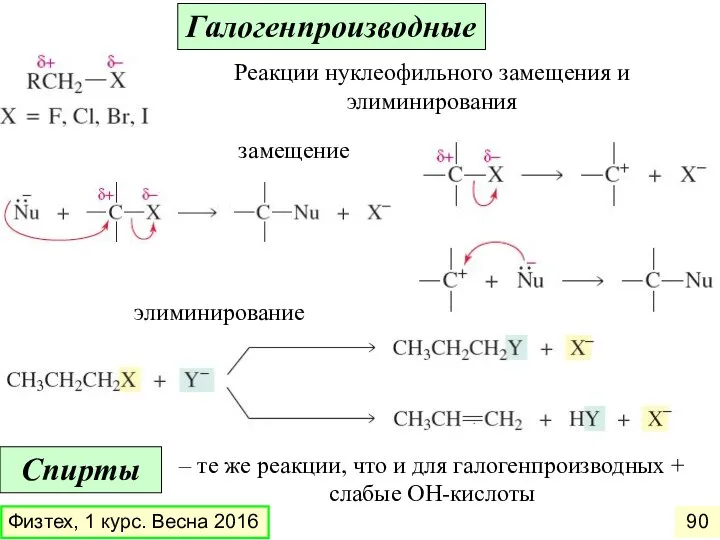
- 90. Галогенпроизводные Спирты Реакции нуклеофильного замещения и элиминирования замещение элиминирование Физтех, 1 курс. Весна 2016 – те
- 91. Альдегиды, кетоны Реакции нуклеофильного присоединения π МО C-О связи Стабилизация аниона при α-углеродном атоме
- 92. Амины Карбоновые кислоты Реакции нуклеофильного замещения δ- δ+ нуклеофил основание Физтех, 1 курс. Весна 2016
- 93. Кислоты и основания в органической химии Теория Бренстеда Физтех, 1 курс. Весна 2016
- 94. Кислоты и основания Льюиса Кислота – частица, способная принимать электрон на вакантную орбиталь Основание – частица,
- 95. Коротко о главном Органическая Химия (ОХ) – дисциплина, изучающая химию соединений углерода с другими элементами. Ее
- 97. Скачать презентацию









































































 Ion exchange
Ion exchange Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск
Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Соли и классы химических веществ
Соли и классы химических веществ Определение разных форм угольной кислоты
Определение разных форм угольной кислоты Строение углеводородов
Строение углеводородов Классификация углеводов. Глюкоза
Классификация углеводов. Глюкоза Синтез новых аллильных производных семикарбазонов и тиосемикарбазонов Пиррол-2-карбальдегидов
Синтез новых аллильных производных семикарбазонов и тиосемикарбазонов Пиррол-2-карбальдегидов Водород
Водород  Валентність
Валентність  Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Основні характеристики атомних електростанцій (АЕС) та підприємств ядерного паливного циклу
Основні характеристики атомних електростанцій (АЕС) та підприємств ядерного паливного циклу Изотермический распад переохлажденного аустенита
Изотермический распад переохлажденного аустенита Презентация по Химии "«Химические волокна»" - скачать смотреть
Презентация по Химии "«Химические волокна»" - скачать смотреть  Три кити нанохімії
Три кити нанохімії Гiдроксикислоти. Номенклатура
Гiдроксикислоти. Номенклатура Комплексные соединения
Комплексные соединения Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Конструкция ферментатора
Конструкция ферментатора Электролитическая диссоциация. Устойчивость комплексных соединений
Электролитическая диссоциация. Устойчивость комплексных соединений Щелочные металлы
Щелочные металлы Низкомолекулярные биорегуляторы терпены
Низкомолекулярные биорегуляторы терпены Серная кислота H2SO4
Серная кислота H2SO4 Хроматографические методы анализа
Хроматографические методы анализа Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия
Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость