Содержание
- 2. Окислительно-восстановительными называют химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов,
- 3. Историческая справка В XVII в. считали, что окисление – потеря флогистона (особого невидимого горючего вещества), а
- 4. Историческая справка С введением в химию электронных представлений точно установлено, что окислитель - вещество, которое получает
- 5. Восстановление Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами. При этом: - происходит понижение
- 6. Восстановление Например: - атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т.е. восстанавливаясь:
- 7. Восстановление - принимать электроны могут и положительные ионы, у которых при этом понижается степень окисления: +3
- 8. Окисление Например: - атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются: 0 +1 Na
- 9. Окисление - терять электроны могут и некоторые положительные ионы с низшими степенями окисления: +1 +2 Cu
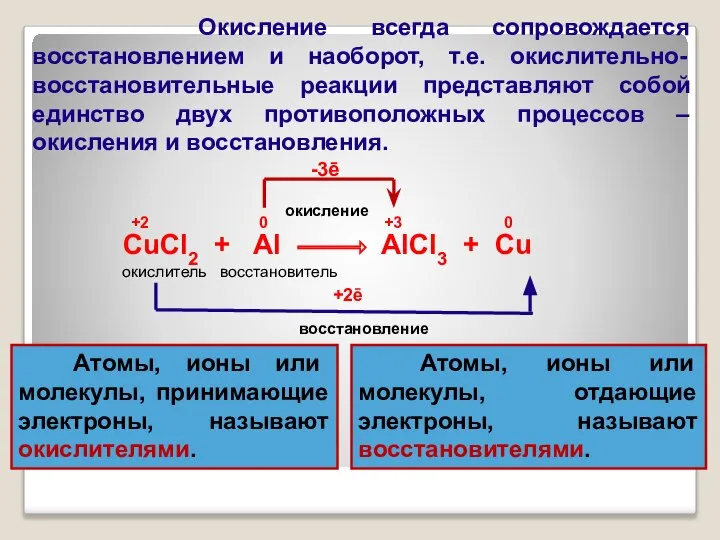
- 10. CuCl2 + Al AlCl3 + Cu окислитель восстановитель +2 0 +3 0 окисление восстановление -3ē +2ē
- 11. Электронный баланс В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается
- 12. Электронный баланс А электронные уравнения будут иметь вид: +2 восстановление 0 Cu + 2ē → Cu
- 13. Электронный баланс Для правильного уравнивания следует придерживаться определенной последовательности действий: 1. Найти окислитель и восстановитель. 2.
- 14. Электронный баланс Дана реакция Li + N2 = Li3N 1. Находим окислитель и восстановитель: Li0 +
- 15. Электронный баланс 3. Уравниваем число отданных и принятых электронов в полуреакции: 6* | Li0 — 1ē
- 16. Электронный баланс 4. Просуммируем порознь левые и правые части полуреакций: 6Li + N2 = 6Li+1 +
- 18. Скачать презентацию














 Репликация ДНК и РНК
Репликация ДНК и РНК Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1
Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1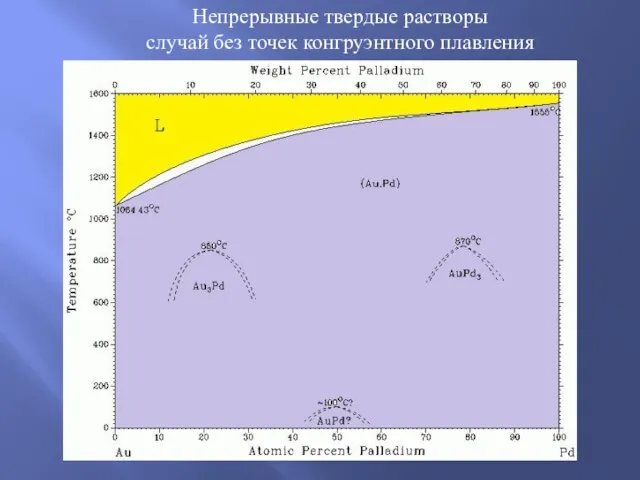 Непрерывные твердые растворы случай без точек конгруэнтного плавления
Непрерывные твердые растворы случай без точек конгруэнтного плавления Сушка в химической промышленности. Свойства влажного воздуха
Сушка в химической промышленности. Свойства влажного воздуха Аминокислоты. Общая формула
Аминокислоты. Общая формула Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Пряности глазами химика
Пряности глазами химика Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen Роль химии в жизни человека
Роль химии в жизни человека Аттестационная работа. Влияние электромагнитного излучения смартфонов на жизнедеятельность микроорганизмов
Аттестационная работа. Влияние электромагнитного излучения смартфонов на жизнедеятельность микроорганизмов Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про Презентация Алкины Ацетилен
Презентация Алкины Ацетилен Наука химия. Роль химии в промышленности
Наука химия. Роль химии в промышленности ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна
ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна  Ионная связь
Ионная связь Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории
Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Современная нефтехимия
Современная нефтехимия Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Оксиген
Оксиген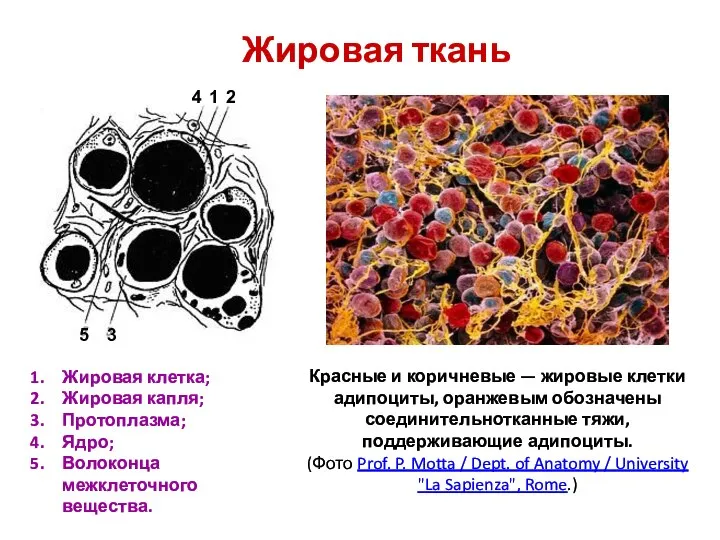 Жировая ткань
Жировая ткань Классификация, номенклатура, изомерия органических соединений
Классификация, номенклатура, изомерия органических соединений Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Динамическая вулканизация термоэластопластов
Динамическая вулканизация термоэластопластов IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Презентация по Химии "Сульфатна кислота і сульфати." - скачать смотреть бесплатно
Презентация по Химии "Сульфатна кислота і сульфати." - скачать смотреть бесплатно Классификация титановых сплавов
Классификация титановых сплавов