Содержание
- 2. Межмолекулярные ОВР А) реакции, в результате которых степень окисления всех элементов остаются без изменения: HNO3 +
- 3. ОКИСЛИТЕЛИ Пример 1: S0 + 2e → S2- Cl20 + 2e → 2Cl- Fe3+ +1e →
- 4. ОКИСЛИТЕЛИ
- 5. ОКИСЛИТЕЛИ
- 6. ОКИСЛИТЕЛИ
- 7. ВОССТАНОВИТЕЛИ
- 8. Алгоритм расстановки коэффициентов в уравнении ОВР, если известны продукты взаимодействия Записать схему реакции – слева исходные
- 9. Алгоритм расстановки коэффициентов в уравнении ОВР, если известны продукты взаимодействия 5. Определить число электронов, отданных восстановителем
- 10. Алгоритм расстановки коэффициентов в уравнении ОВР, если известны продукты взаимодействия 8. Определить число электронов, полученных окислителем
- 11. Алгоритм расстановки коэффициентов в уравнении ОВР, если известны продукты взаимодействия 10. Найти коэффициенты при каждом электронном
- 12. ПРИМЕР: Fe+2S2-1 + O20 = Fe2+3O3-2 + S+4O2-2 Fe+2 - 1e = Fe+3 восстановитель, окисляется S-1
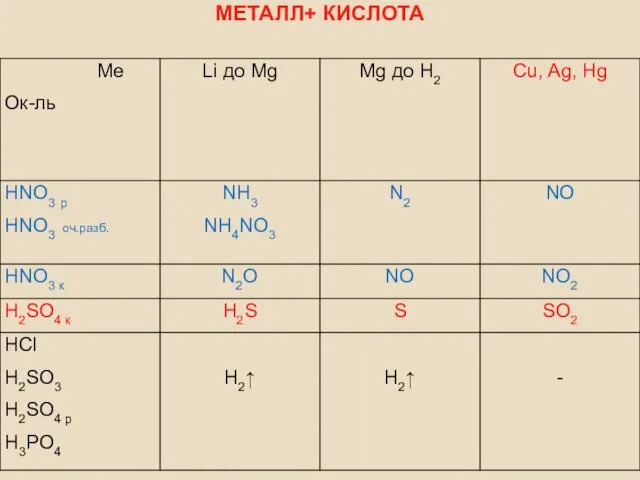
- 13. МЕТАЛЛ+ КИСЛОТА
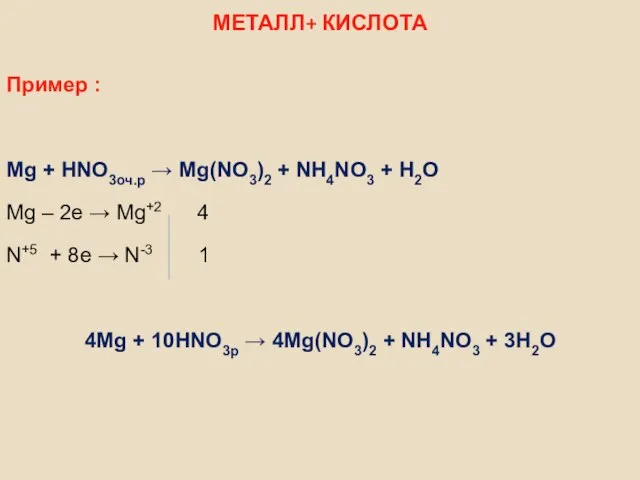
- 14. МЕТАЛЛ+ КИСЛОТА Пример : Mg + HNO3оч.p → Mg(NO3)2 + NH4NO3 + H2O Mg – 2e
- 15. Внутримолекулярные ОВР Пример: Cl+5 +6e → Cl-1 2 - окислитель 2O-2 -4e → O2 3 -
- 16. Задания для самостоятельной работы Какие из следующих реакций являются окислительно-восстановительными: А) KOH + CuCl2 → KCl
- 17. 3. Какие из следующих веществ могут быть: А) только окислителями Б) только восстановителями В) и окислителями
- 18. 5. Методом электронного баланса составьте уравнения окислительно-восстановительных реакций, которые протекают по схемам: H2S + K2Cr2O7 +
- 19. 6. К какому типу окислительно-восстановительных реакций относится каждая из следующих реакций: H2O2 + K2Cr2O7 + HCl
- 20. ТЕСТЫ Вариант №1 Какие из следующих веществ могут являться окислителями? А) NH3 Б) Br2 В) KClO3
- 22. Скачать презентацию

















 Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Металлы
Металлы Ион алмасу әдістері арқылы қолданылатын ионидтер. Ионидтерге қойылатын талаптар
Ион алмасу әдістері арқылы қолданылатын ионидтер. Ионидтерге қойылатын талаптар Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Фосфор. Характеристика элемента
Фосфор. Характеристика элемента Язык химии
Язык химии Соединения галогенов
Соединения галогенов Связь ЭДС с составом фаз. Вывод из межфазных равновесий
Связь ЭДС с составом фаз. Вывод из межфазных равновесий Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2
Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2 Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл
Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл Соли: свойства, получение, применение
Соли: свойства, получение, применение Химический элемент кремний
Химический элемент кремний Степень окисления. Урок № 63
Степень окисления. Урок № 63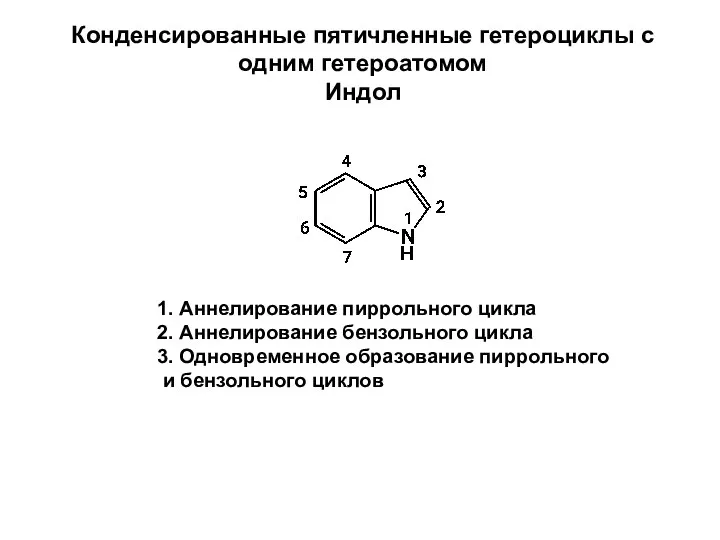 Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол
Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол Азот
Азот Кислоты. Физические свойства кислот
Кислоты. Физические свойства кислот Минералдарды зерттеу әдістері
Минералдарды зерттеу әдістері Коррозия металлов
Коррозия металлов Строение атомов. Периодическая система. Лекция 2
Строение атомов. Периодическая система. Лекция 2 Кислоты и соли. (8 класс)
Кислоты и соли. (8 класс) Frunol delicia GmbH. Витаминизированные жидкие удобрения
Frunol delicia GmbH. Витаминизированные жидкие удобрения Основные классы неорганических соединений
Основные классы неорганических соединений Презентация по Химии "Кристаллы" - скачать смотреть
Презентация по Химии "Кристаллы" - скачать смотреть  Типы металлоферментов их структурная и функциональная классификация
Типы металлоферментов их структурная и функциональная классификация Презентация по Химии "Алюміній" - скачать смотреть бесплатно
Презентация по Химии "Алюміній" - скачать смотреть бесплатно Горные породы
Горные породы Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.