Содержание
- 2. 1. Исходя из положения элементов в Периодической системе, предложите формулы бинарных соединений элементов главной подгруппы VI
- 3. 2. Напишите уравнения реакций гидроксида кальция с серной кислотой, в которых образуются основные, средние и кислые
- 4. 3. Напишите формулы следующих соединений: сульфид висмута(III); тетраоксоманганат(VI) калия; нонахлорид трирения; гексаоксоиодат триводорода дикалия; тетраоксид димарганца(III)
- 5. 4 Как изменяются кислотно-основные свойства гидроксидов элементов второй группы ПС? Дайте объяснение этому явлению.
- 6. 5 Укажите способы получения простых веществ – галогенов (F2, Cl2, I2), кислорода и халькогенов (S, Se),
- 7. 6 Напишите уравнения реакций и укажите условия, необходимые для проведения процесса: CuO + H2 → NaH
- 8. 7. Напишите уравнения реакций, соответствующих приведенной схеме, и укажите условия их проведения. FeS2 → SO2 →
- 9. 8. В трех колбах находятся водные растворы: а) хлорида марганца(II); б) бромида алюминия; в) трииодида натрия.
- 10. Порошок оксида хрома (Cr2O3) сплавили на воздухе с карбонатом калия. После охлаждения плав растворили в воде.
- 12. Скачать презентацию









 Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Металлы
Металлы Ион алмасу әдістері арқылы қолданылатын ионидтер. Ионидтерге қойылатын талаптар
Ион алмасу әдістері арқылы қолданылатын ионидтер. Ионидтерге қойылатын талаптар Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Фосфор. Характеристика элемента
Фосфор. Характеристика элемента Язык химии
Язык химии Соединения галогенов
Соединения галогенов Связь ЭДС с составом фаз. Вывод из межфазных равновесий
Связь ЭДС с составом фаз. Вывод из межфазных равновесий Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2
Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2 Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл
Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл Соли: свойства, получение, применение
Соли: свойства, получение, применение Химический элемент кремний
Химический элемент кремний Степень окисления. Урок № 63
Степень окисления. Урок № 63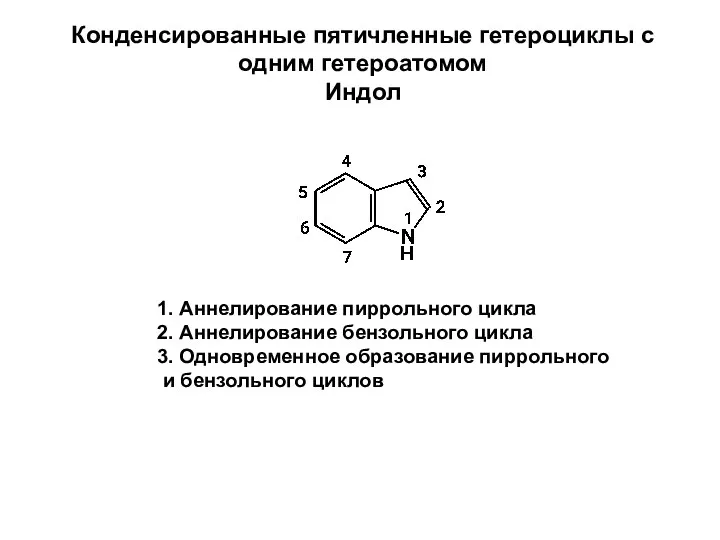 Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол
Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол Азот
Азот Кислоты. Физические свойства кислот
Кислоты. Физические свойства кислот Минералдарды зерттеу әдістері
Минералдарды зерттеу әдістері Коррозия металлов
Коррозия металлов Строение атомов. Периодическая система. Лекция 2
Строение атомов. Периодическая система. Лекция 2 Кислоты и соли. (8 класс)
Кислоты и соли. (8 класс) Frunol delicia GmbH. Витаминизированные жидкие удобрения
Frunol delicia GmbH. Витаминизированные жидкие удобрения Основные классы неорганических соединений
Основные классы неорганических соединений Презентация по Химии "Кристаллы" - скачать смотреть
Презентация по Химии "Кристаллы" - скачать смотреть  Типы металлоферментов их структурная и функциональная классификация
Типы металлоферментов их структурная и функциональная классификация Презентация по Химии "Алюміній" - скачать смотреть бесплатно
Презентация по Химии "Алюміній" - скачать смотреть бесплатно Горные породы
Горные породы Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.