Содержание
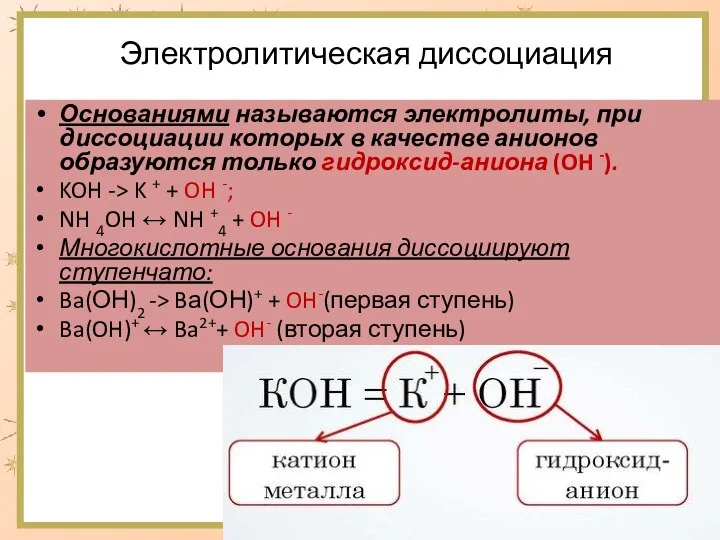
- 3. Электролитическая диссоциация Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-аниона (OH -).
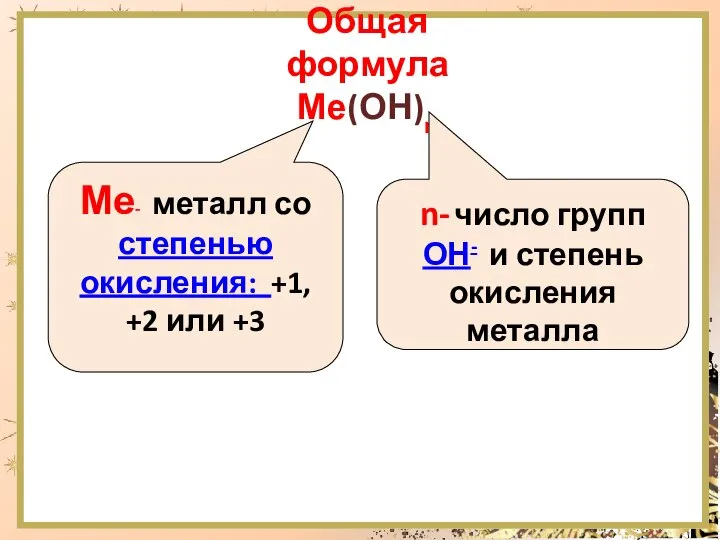
- 4. Общая формула Ме(ОН)n Ме- металл со степенью окисления: +1, +2 или +3 n- число групп ОН-
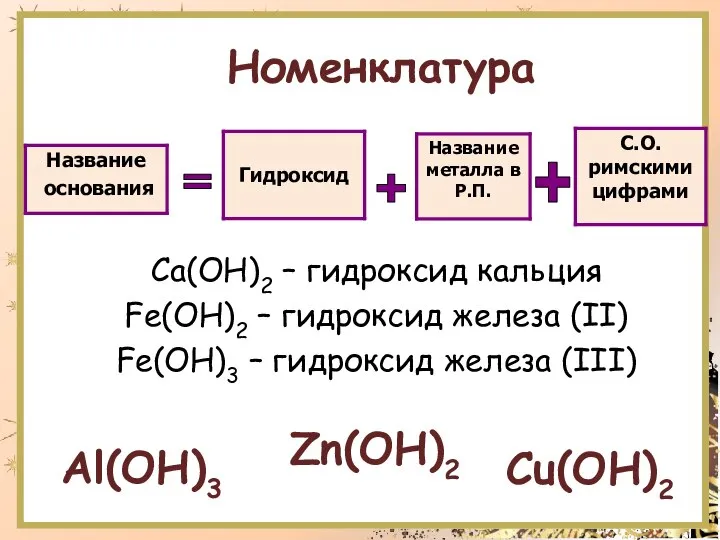
- 5. Номенклатура Ca(OH)2 – гидроксид кальция Fe(OH)2 – гидроксид железа (II) Fe(OH)3 – гидроксид железа (III) =
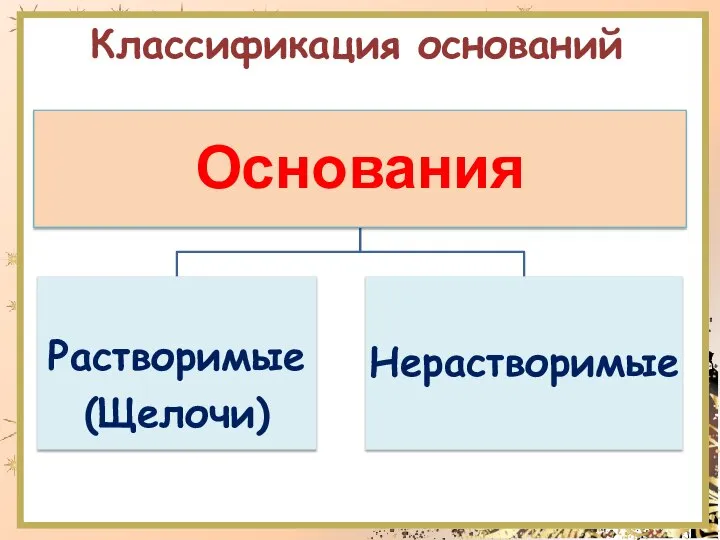
- 7. Классификация оснований
- 8. KOH LiOH Ca(OH)2 Mn(OH)2 Fe(OH)3 Al(OH)3
- 24. Скачать презентацию

















 Химическая организация клетки
Химическая организация клетки Классы дисперсных систем (аэрозоли, порошки, суспензии, эмульсии). Мицеллярные коллоидные системы. Лекция 5
Классы дисперсных систем (аэрозоли, порошки, суспензии, эмульсии). Мицеллярные коллоидные системы. Лекция 5 Водород
Водород Пищевые добавки
Пищевые добавки Электрохимические процессы
Электрохимические процессы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кислород
Кислород Виробництво біогазу Виконав: студент IV курсу групи БЛБ-43з Вила Віктор
Виробництво біогазу Виконав: студент IV курсу групи БЛБ-43з Вила Віктор  Липиды. Общая характеристика липидов
Липиды. Общая характеристика липидов Нанотехнологии и науки о материалах
Нанотехнологии и науки о материалах Изотермический процесс в реакционном объеме. (Тема 6.2)
Изотермический процесс в реакционном объеме. (Тема 6.2) Вода
Вода Растворы и растворимость. (8 класс)
Растворы и растворимость. (8 класс) Основы общей химии
Основы общей химии Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры «НЕМНОГО О МЕТАЛЛАХ И МЕТАЛЛУРГИИ» ХИМИЧЕСКАЯ ВИКТОРИНА учитель химии МКОУ СОШ №14 пос. Пятигорский Балацкая Татьяна Алексеевна
«НЕМНОГО О МЕТАЛЛАХ И МЕТАЛЛУРГИИ» ХИМИЧЕСКАЯ ВИКТОРИНА учитель химии МКОУ СОШ №14 пос. Пятигорский Балацкая Татьяна Алексеевна Ферменты строение и свойства. Регуляция активности ферментов. (Лекция 1.3)
Ферменты строение и свойства. Регуляция активности ферментов. (Лекция 1.3) Химия ғажайыптары
Химия ғажайыптары Комплексные соединения
Комплексные соединения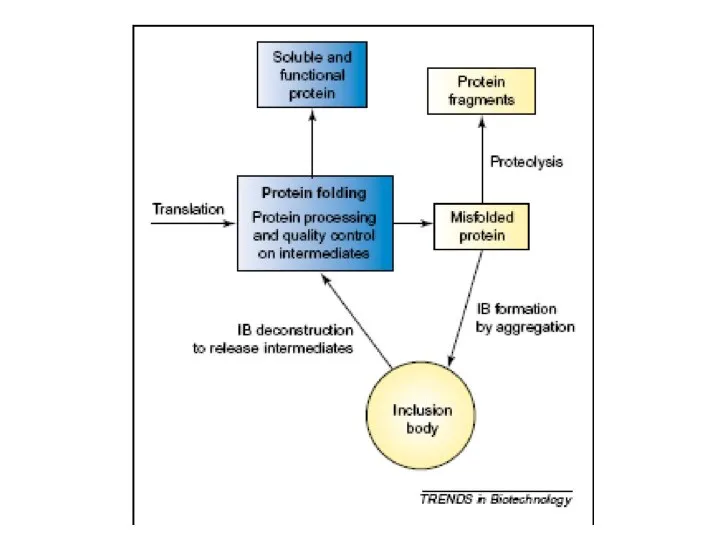 Рефолдинг миниантител
Рефолдинг миниантител Кислоты. Соли (8 класс)
Кислоты. Соли (8 класс) Моделі будови атома
Моделі будови атома Осадочные горные породы
Осадочные горные породы Спирты
Спирты Реакции ионного обмена
Реакции ионного обмена Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Производные пиридин-4-карбоновой кислоты
Производные пиридин-4-карбоновой кислоты Презентация по химии ПЕПТИДЫ и Белки
Презентация по химии ПЕПТИДЫ и Белки