Содержание
- 2. Основные законы химии Закон сохранения массы Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции.
- 3. Основные законы химии Закон постоянства состава Каждое вещество, каким бы способом оно ни было получено, всегда
- 4. Основные законы химии Закон кратных отношений Если два элемента образуют между собой несколько соединений, то массовые
- 5. Основные законы химии Закон Авогадро В равных объемах различных газов при одинаковых условиях (температура и давление)
- 7. Скачать презентацию




 Кинетика химических реакций. (Лекция 12)
Кинетика химических реакций. (Лекция 12) Углеводороды. Природный газ. Алканы
Углеводороды. Природный газ. Алканы Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений Исследование химического состава шоколада и способов его приготовления
Исследование химического состава шоколада и способов его приготовления Природные источники углеводородов
Природные источники углеводородов Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ
Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ Химические свойства карбокатионов
Химические свойства карбокатионов Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Химия переходных элементов
Химия переходных элементов ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале
ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие
Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Презентация по Химии "Азотная кислота" - скачать смотреть
Презентация по Химии "Азотная кислота" - скачать смотреть  Історія виникнення мила Розмаїтого Дмитра, 9-Б клас
Історія виникнення мила Розмаїтого Дмитра, 9-Б клас  Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Тривиальные названия неорганических соединений
Тривиальные названия неорганических соединений Структура аминокислот
Структура аминокислот Дифференцированный подход в обучении химии
Дифференцированный подход в обучении химии Физико-химические методы анализа
Физико-химические методы анализа Кинетические методы анализа
Кинетические методы анализа Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы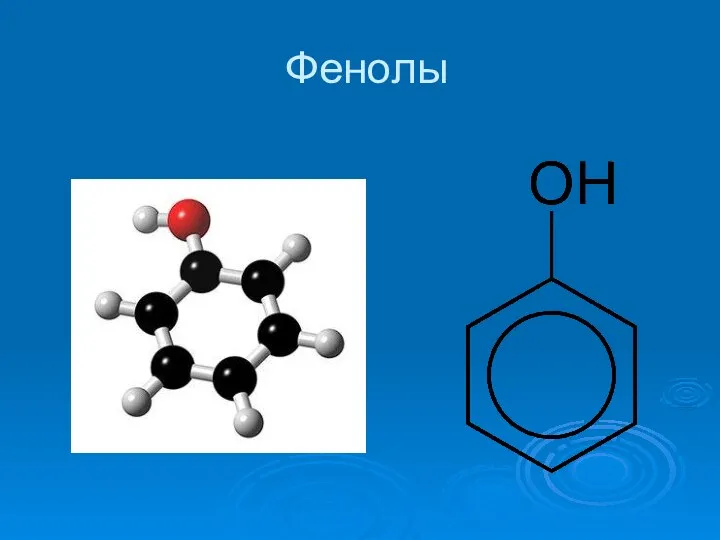 Фенолы. Физические свойства. Получение
Фенолы. Физические свойства. Получение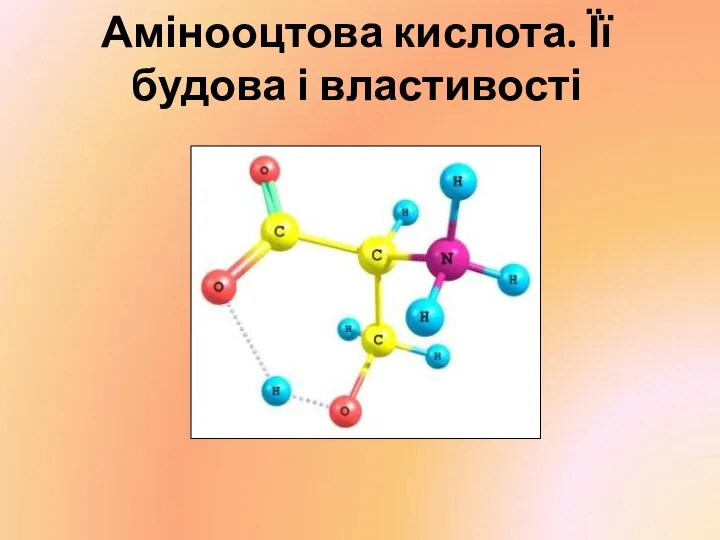 Амінооцтова кислота. Її будова і властивості
Амінооцтова кислота. Її будова і властивості Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері
Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері Пища, с точки зрения химика
Пища, с точки зрения химика Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией  Классификация минералов по химическому принципу
Классификация минералов по химическому принципу