Содержание
- 3. К p-элементам III-A группы относятся бор В алюминий Al и элементы семейства галлия – галлий Ga,
- 4. С увеличением порядкового номера энергия ионизации атомов уменьшается, а металлические свойства элементов III-A группы, как и
- 5. Бор – неметалл, таллий – типичный элемент металл. Металлические свойства этих элементов выражены слабее, чем соответствующих
- 6. Степени окисления: +3, -3, +1, -1. Для таллия наиболее устойчивы соединения, где степень окисления равна +1.
- 7. История открытия и получения бора. Название элемента появилось за тысячу лет до его открытия, во времена
- 8. Позже в 1856 году химики А. Девиль и Ф. Велер выяснили, что бор может существовать в
- 9. Споры о свойствах бора в чистом состоянии не затихали примерно 100 лет после первого его выделения.
- 10. В настоящее время Bкристаллический получают аналогично восстановлением галогенидов водородом: t 2BBr3 + 3H2 → 2B +
- 11. Технический Bаморфный получают Mg-термическим восстановлением борного ангидрида, образующегося при термическом разложении борной кислоты. Методика была предложена
- 12. БОР. Содержание в земной коре составляет 3·10-4%. В свободном состоянии не встречается. Основные минералы: Na2B4O7 ·
- 13. Бор – первый p-элемент в периодической системе элементов. Строение электронной оболочки атома в невозбужденном состоянии: 2p
- 14. При комнатной температуре бор инертен и непосредственно взаимодействует со фтором, образуя BF3, где имеет место sp2-гибридизация,
- 15. В кислотах, не являющихся окислителями, бор не растворяется. Он взаимодействует при нагревании с конц. H2SO4, HNO3,
- 16. При нагревании бора с галогенами получаются галогениды: BF3, BCl3: газы BBr3: жидкость BI3: кристаллическое вещество Галогениды
- 17. Вещества, реагирующие необратимо с водой с образованием двух кислот, одна из которых галогеноводородная, называются галогеноангидридами. Таким
- 18. При нагревании бор взаимодействует со многими металлами, образуя бориды. Это кристаллические тугоплавкие вещества. Почти все бориды
- 19. Большинство металлов в зависимости от условий синтеза образуют бориды различного состава. При действии разбавленной HCl на
- 20. Простейшие водородные соединения бора – BH3 в обычных условиях не существует. Из выделенных в свободном состоянии
- 21. H H H B B H H H Бороводороды – соединения с дефицитом электронов. Например: в
- 22. В диборане имеют место двухцентровые и трехцентровые связи. Две концевые BH2 лежат в одной плоскости, а
- 23. Она возникает в результате перекрывания двух sp2-гибридных орбиталей бора и 1s-орбитали атома H, что и обеспечивает
- 24. Гидриды бора разлагаются водой, спиртами, щелочами с выделением водорода B2H6 + 6H2O → 2H3BO3 + 3H2↑
- 25. Борогидриды лития и натрия используют в органических синтезах как сильные восстановители. Чаще используют Na[BH4] – белое
- 26. Тетрафторобораты очень разнообразны, хорошо растворимы в воде, мало растворимы - K[BF4], Rb[BF4], Cs[BF4]. Все эти комплексы
- 27. С кислородом бор образует борный ангидрид B2O3 – кристаллическое вещество. В газообразном состоянии молекула B2O3 имеет
- 28. При взаимодействии с водой вначале образуются метаборная кислота, а дальнейшее обводнение приводит к образованию ортоборной кислоты:
- 29. Ортоборная кислота или ортоборат водорода при нагревании теряет воду, переходя в полимерные метабораты водорода HBO2 и
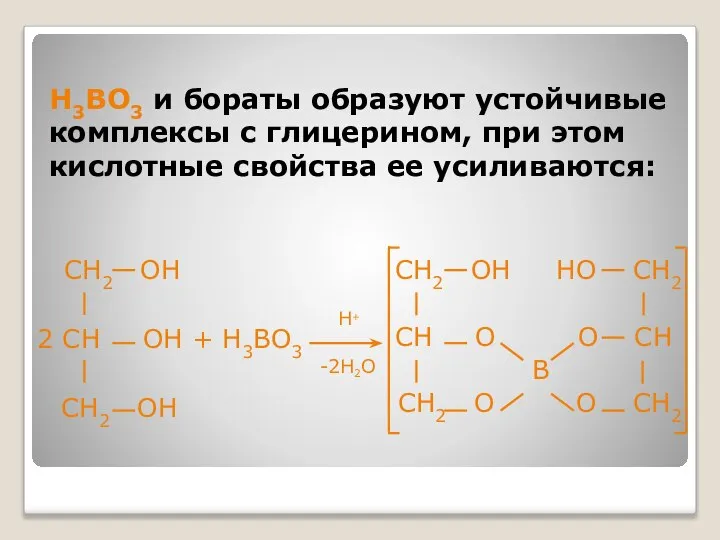
- 30. H3BO3 и бораты образуют устойчивые комплексы с глицерином, при этом кислотные свойства ее усиливаются: CH2 OH
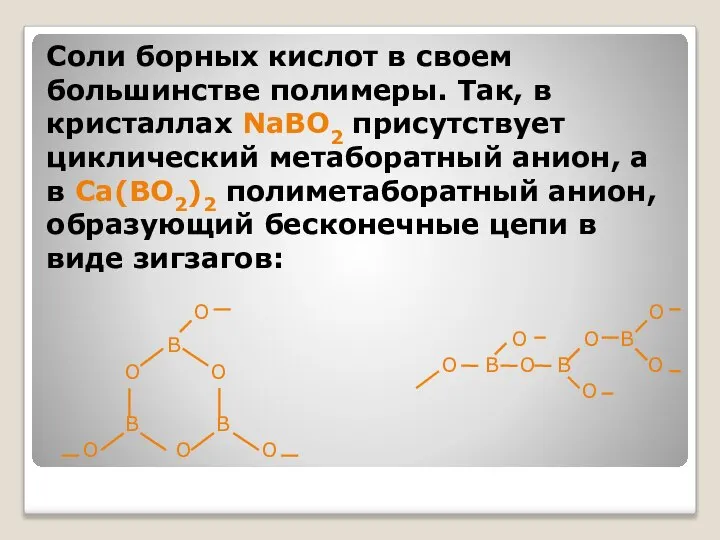
- 31. Соли борных кислот в своем большинстве полимеры. Так, в кристаллах NaBO2 присутствует циклический метаборатный анион, а
- 32. Эти анионы состоят из плоских треугольных структурных единиц BO3 4H3BO3 → H2B4O7 + 5H2O H3BO3 –
- 33. Качественной реакцией на H3BO3 и соли борных кислот является взаимодействие с H2SO4 (к) и метанолом (этанолом)
- 34. При нейтрализации H3BO3 не образуются ортобораты, содержащие ион BO33-, а получаются тетрабораты, метабораты: 4H3BO3 + 2NaOH
- 35. Невозможность получения ортоборатов объясняется малой диссоциацией H3BO3, приводящей к практически полному гидролизу ее солей: Na2B4O7 +
- 36. Применение в фармации. Кислота борная, натрия тетраборат применяются наружно в качестве антисептических средств. Алюминия гидроксид применяется
- 37. АЛЮМИНИЙ Характерная степень окисления +3. КЧ=6; 4. Содержание Al в земной коре составляет 2,8%.
- 38. Основным сырьем для получения алюминия являются бокситы, содержащие до 60% глинозема Al2O3. Перспективным является выделение его
- 40. На воздухе алюминий покрывается тончайшей пленкой Al2O3, отличающейся большой прочностью. Это объясняет его устойчивость при комнатной
- 41. Наличие в валентном слое незаполненных p- и d-орбиталей дает возможности для донорно-акцепторного взаимодействия. Ион Al3+ проявляет
- 42. При комплексообразовании в химическую связь могут вносить вклад свободные d-орбитали. Поэтому существуют комплексы с КЧ=6. Например:
- 43. Металлический алюминий, поверхность которого покрыта защитной пленкой Al2O3 не реагирует с водой, но если ее разрушить,
- 44. При нагревании Al энергично взаимодействует с O2, S, N2, но не реагирует с H2. 4Al +
- 45. Однако очень разбавленные и очень концентрированные растворы HNO3 и H2SO4 на Al практически не действуют –
- 46. С растворами щелочей алюминий взаимодействует энергично, поскольку они растворяют оксидную защитную пленку: 2Al + 6NaOH +
- 47. Al не вступает в реакцию с водородом H2. Гидрид Al (алан) получают косвенным путем, действуя LiH
- 48. Оксид Al - Al2O3 – очень твердое тугоплавкое соединение, известно его 3 модификации – . Al2O3
- 49. Гидроксид алюминия - Al(OH)3 Получают: Al2(SO4)3 + 6NaOH → 2Al(OH)3 студ.белый осадок + 3Na2SO4 Al(OH)3 –
- 50. В отличие от многих гидроксидов d-элементов Al(OH)3 не растворяется в NH3 Галиды алюминия (галогениды) получают прямым
- 51. AlCl3 – малорастворимое и тугоплавкое вещество, остальные хорошо растворимы, причем при растворении их в воде выделяется
- 52. Далее образуются различные полиядерные комплексы [Al2(OH)2]4+, которые остаются в растворе, поэтому не наблюдается образование осадка гидроксида,
- 53. Биологическая роль Алюминий и бор относятся к примесным микроэлементам. Концентрируются в сыворотке крови, легких, мозге, печени,
- 54. Избыток бора вреден для организма, так как он угнетает амилазы, протеиназы, уменьшает активность адреналина, нарушает в
- 56. Скачать презентацию























![Тетрафторобораты очень разнообразны, хорошо растворимы в воде, мало растворимы - K[BF4],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397693/slide-25.jpg)























![Далее образуются различные полиядерные комплексы [Al2(OH)2]4+, которые остаются в растворе, поэтому](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397693/slide-51.jpg)


 Каталитический крекинг
Каталитический крекинг Винная кислота
Винная кислота Кривые титрования. (Лекция 6)
Кривые титрования. (Лекция 6) Липидтердің метаболизмі
Липидтердің метаболизмі Кам'яне вугілля Тверда горюча корисна копалина, один з видів вугілля викопного, проміжний між бурим вугіллям і антрацитом
Кам'яне вугілля Тверда горюча корисна копалина, один з видів вугілля викопного, проміжний між бурим вугіллям і антрацитом  Crystal Defects and Noncrystalline Structure–Imperfection
Crystal Defects and Noncrystalline Structure–Imperfection ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.
ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.  Химикаты для сельского хозяйства
Химикаты для сельского хозяйства Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Щелочноземельные металлы
Щелочноземельные металлы Пральні порошки. Мила
Пральні порошки. Мила  Атомы и молекулы
Атомы и молекулы Екобригада ДЗВІН ЗЕМЛІ Чортківська ЗОШ І-ІІІ ст №5
Екобригада ДЗВІН ЗЕМЛІ Чортківська ЗОШ І-ІІІ ст №5 Что изучает химия
Что изучает химия Номенклатура алканов
Номенклатура алканов Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Катаболизм и анаболизм. Общий путь катаболизма. Окислительное декарбоксилирование ПВК. Цикл Кребса
Катаболизм и анаболизм. Общий путь катаболизма. Окислительное декарбоксилирование ПВК. Цикл Кребса Обмен липидов. Переваривание и всасывание липидов. (Тема 2-3)
Обмен липидов. Переваривание и всасывание липидов. (Тема 2-3) Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров
Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров Використання вуглеводнів
Використання вуглеводнів Фенол 10 класс - Презентация по Химии
Фенол 10 класс - Презентация по Химии Презентация по Химии "Сера" - скачать смотреть
Презентация по Химии "Сера" - скачать смотреть  Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Карбоновые кислоты
Карбоновые кислоты Лектор Турло Евгений Михайлович Доцент кафедры химии, кандидат педагогических наук ׀-410
Лектор Турло Евгений Михайлович Доцент кафедры химии, кандидат педагогических наук ׀-410 Классификация элементов. III тип. Концентрационные элементы
Классификация элементов. III тип. Концентрационные элементы Блеск и сила здоровых волос
Блеск и сила здоровых волос