Содержание
- 2. План лекции 1. Сущность периодического закона. Причина периодической повторяемости химических свойств и количественных характеристик атомов с
- 3. 3 п.1. Сущность периодического закона. Причина периодической повторяемости химических свойств и количественных характеристик атомов с увеличением
- 4. 4
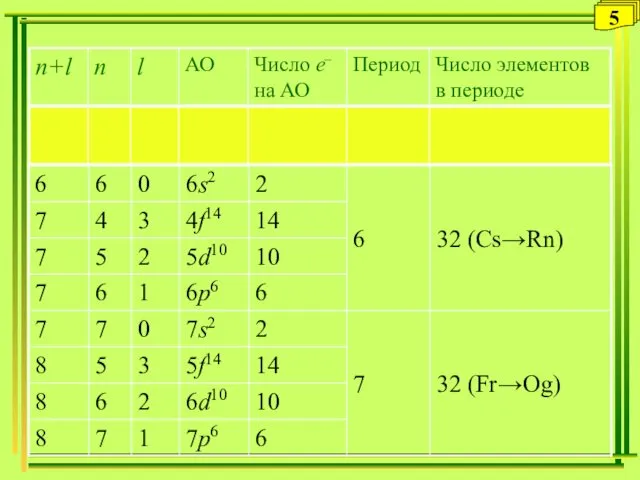
- 5. 5
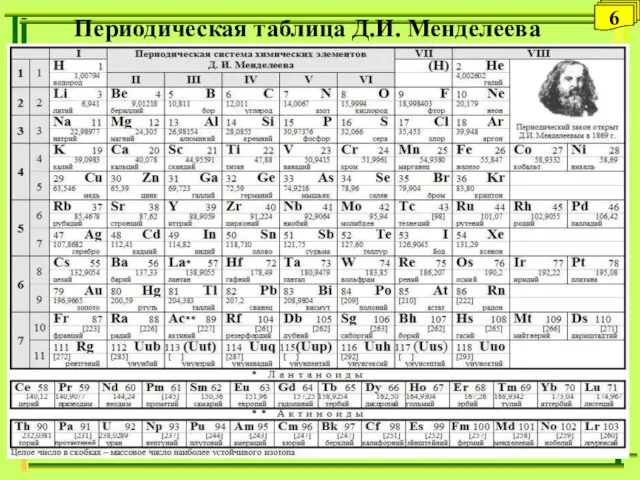
- 6. Периодическая таблица Д.И. Менделеева 6
- 7. 7
- 8. Периодический закон "Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости
- 9. Периодический закон сегодня: "Свойства химических элементов, а также образуемых ими простых и сложных веществ находятся в
- 10. Периодическая система химических элементов Периодическая система химических элементов - естественная классификация химических элементов, являющаяся табличным выражением
- 11. Периодичность Периодичность – это повторяемость химических и физических свойств элементов и их соединений по определенному направлению
- 12. 12 п.2. Строение периодической системы химических элементов Д.И. Менделеева. Характер и причины изменения металлических и неметаллических
- 13. Энергия ионизации Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая для удаления электрона из атома:
- 14. Сродство к электрону Сродство атома к электрону Ee – способность атомов присоединять добавочный электрон и превращаться
- 15. Электроотрицательность (абсолютная электроотрицательность) Относительная электроотрицательность: χLi = 1 χF = 4 Лайнус-Карл ПОЛИНГ (28.02.1901 – 19.08.1994)
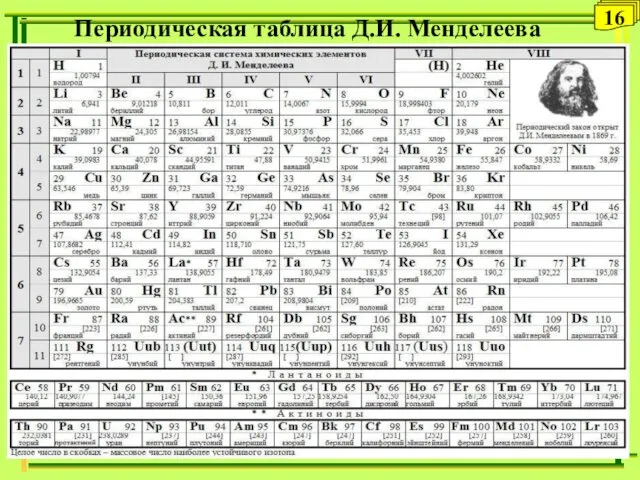
- 16. Периодическая таблица Д.И. Менделеева 16
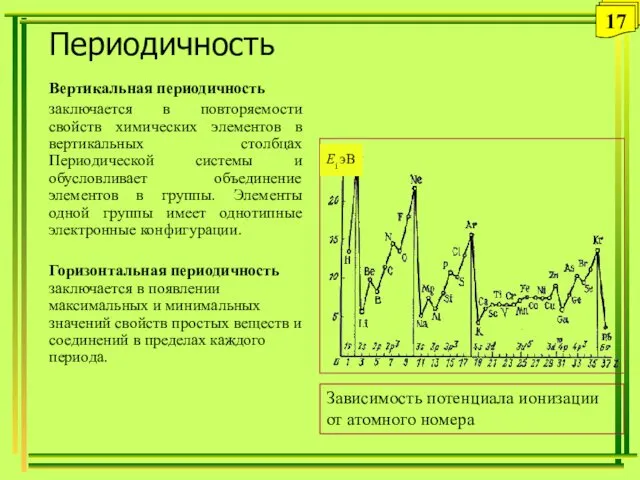
- 17. Периодичность Вертикальная периодичность заключается в повторяемости свойств химических элементов в вертикальных столбцах Периодической системы и обусловливает
- 18. П.3 Электронные s-,p-,d и f- семейства это связь между положением элемента в периодической системе и электронным
- 19. п.3. Основные типы химической связи (ковалентная, ионная, металлическая, водородная), механизм их образования и свойства. Под химической
- 20. Ковалентная химическая связь это связь, возникающая между атомами за счет образования общих электронных пар 20 Параметры
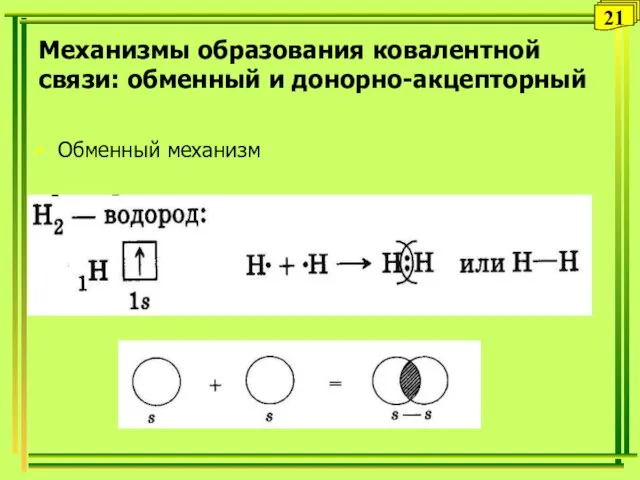
- 21. Обменный механизм 21 Механизмы образования ковалентной связи: обменный и донорно-акцепторный
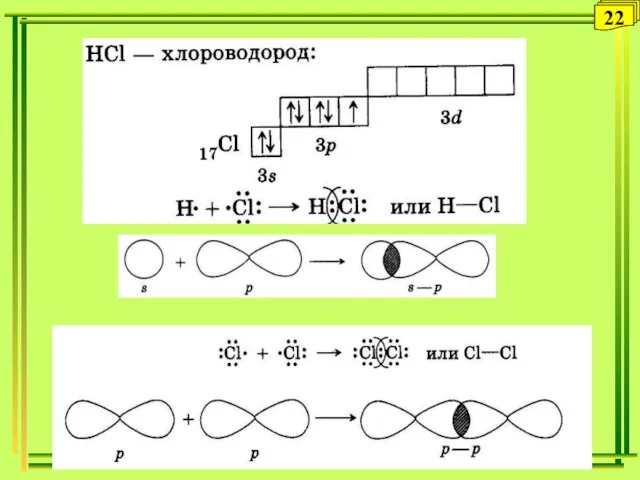
- 22. 22
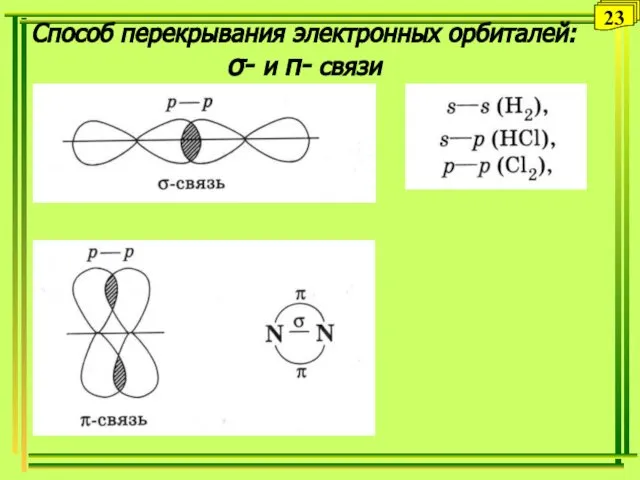
- 23. Способ перекрывания электронных орбиталей: σ- и π- связи 23
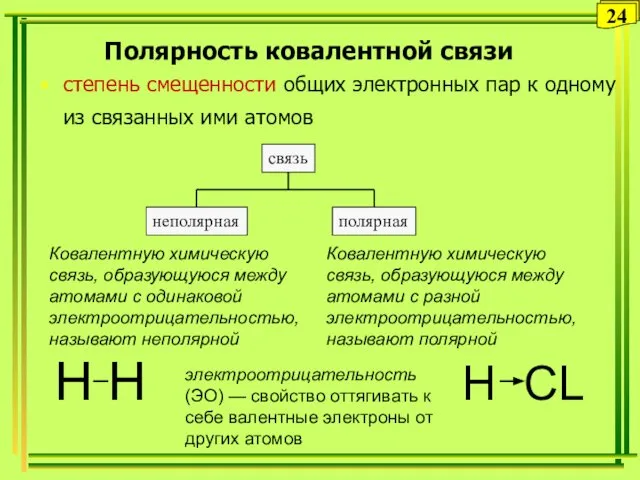
- 24. Полярность ковалентной связи степень смещенности общих электронных пар к одному из связанных ими атомов электроотрицательность (ЭО)
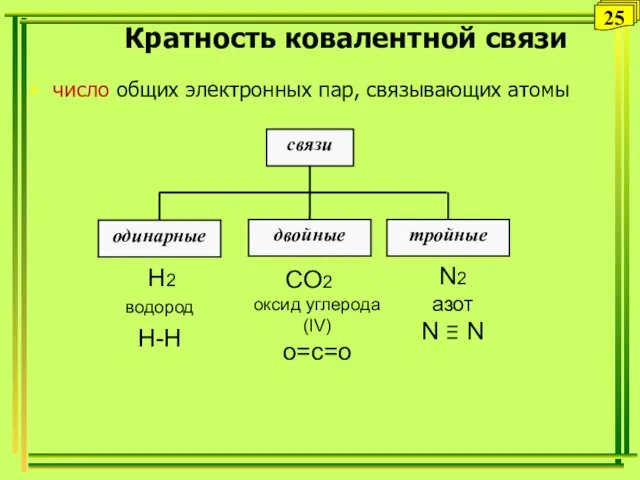
- 25. Кратность ковалентной связи число общих электронных пар, связывающих атомы 25
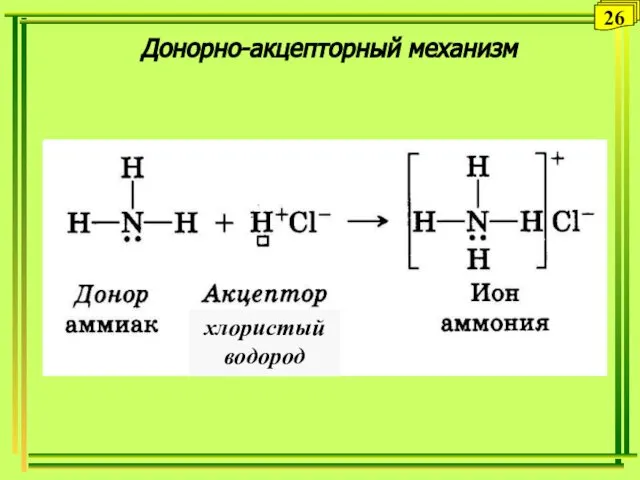
- 26. Донорно-акцепторный механизм 26
- 27. Гибридизация атомных орбиталей Гибридизация – это выравнивание (усреднение) энергетических и геометрических характеристик атомных орбиталей разных подуровней
- 28. Примеры гибридизации (sp) 4Be: [He]2s2 4Be*: [He]2s12p1 s-АО + p-АО = 2sp-АО 28
- 29. Примеры гибридизации (sp2) 5B: [He]2s22p1 5B*: [He]2s12p2 s-АО + 2p-АО = 3sp2-АО Плоский треугольник 29
- 30. Примеры гибридизации (sp3) 6С: [He]2s22p2 6С*: [He]2s12p3 s-АО + 3p-АО = 4sp3-АО Тетраэдр 30
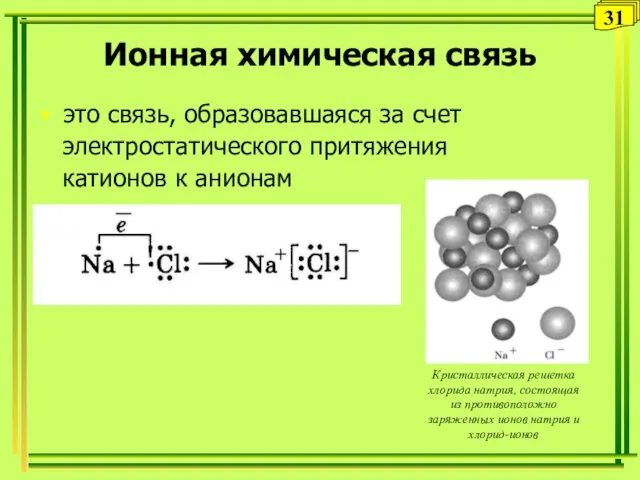
- 31. Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов к анионам 31 Кристаллическая решетка
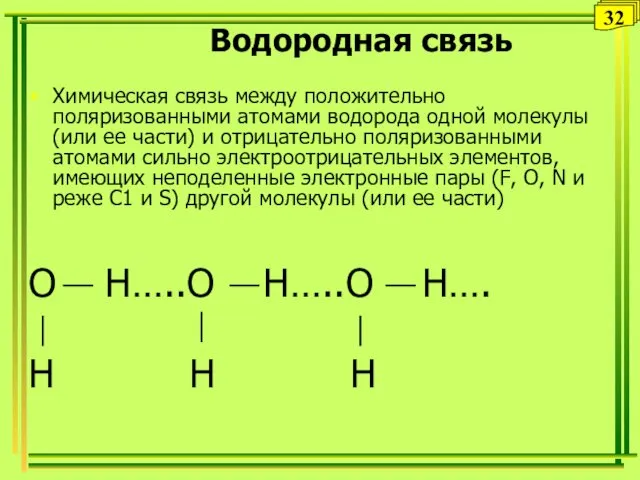
- 32. Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно
- 33. Металлическая связь связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в
- 34. 34 Вопросы к экзамену по общей и неорганической химии 1. Понятия: материя, вещество. Предмет науки химия
- 36. Скачать презентацию















![Примеры гибридизации (sp) 4Be: [He]2s2 4Be*: [He]2s12p1 s-АО + p-АО = 2sp-АО 28](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/479426/slide-27.jpg)
![Примеры гибридизации (sp2) 5B: [He]2s22p1 5B*: [He]2s12p2 s-АО + 2p-АО = 3sp2-АО Плоский треугольник 29](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/479426/slide-28.jpg)
![Примеры гибридизации (sp3) 6С: [He]2s22p2 6С*: [He]2s12p3 s-АО + 3p-АО = 4sp3-АО Тетраэдр 30](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/479426/slide-29.jpg)


 Углеводороды. Химический диктант
Углеводороды. Химический диктант Корозія металів. Засоби захисту від корозії
Корозія металів. Засоби захисту від корозії  Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии
Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии Натуральный каучук
Натуральный каучук Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа Dmitri Ivanovich Mendeleev
Dmitri Ivanovich Mendeleev становление органической химии. Выполнила Кириллова Анастасия 2009г.
становление органической химии. Выполнила Кириллова Анастасия 2009г.  Диеновые углеводороды (алкадиены)
Диеновые углеводороды (алкадиены) Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии
Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Открытие кремния
Открытие кремния Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Железо и его соединения
Железо и его соединения БИОГЕННАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Работу выполнила: ученица 11 класса « Б » средней школы №8
БИОГЕННАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Работу выполнила: ученица 11 класса « Б » средней школы №8  Двойной электрический слой (ДЭС)
Двойной электрический слой (ДЭС) Презентация Благородные газы
Презентация Благородные газы Защита полимеров от старения
Защита полимеров от старения Ячеечная модель реакторов
Ячеечная модель реакторов Кремний и 4 группа. 9 класс
Кремний и 4 группа. 9 класс Оценка солености воды реки Цны и питьевой бутилированной воды
Оценка солености воды реки Цны и питьевой бутилированной воды Современные средства поражений Их краткая характеристика Поражающие факторы
Современные средства поражений Их краткая характеристика Поражающие факторы  Альтернативні види палива
Альтернативні види палива  Физико - химические основы получения лекарственных препаратов (лекция 3)
Физико - химические основы получения лекарственных препаратов (лекция 3) Гидроксиды металлов
Гидроксиды металлов Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Альдоль-кротоновая конденсация альдегидов и кетонов
Альдоль-кротоновая конденсация альдегидов и кетонов Тема урока: «Спирты- в жизни человека» Предмет: Химия Преподаватель: Богданова Елена Владимировна Класс: 10 (1 курс педлицея) при ГО
Тема урока: «Спирты- в жизни человека» Предмет: Химия Преподаватель: Богданова Елена Владимировна Класс: 10 (1 курс педлицея) при ГО Минеральные продукты
Минеральные продукты