Содержание
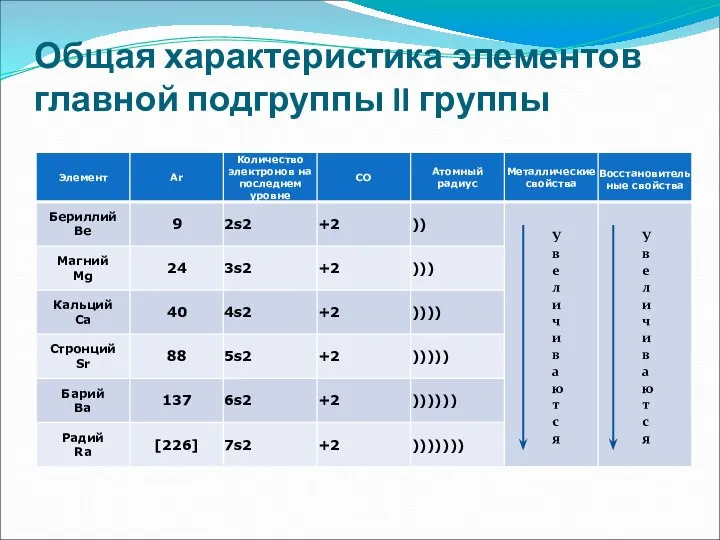
- 2. Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а
- 3. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 4. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют СО +2
- 5. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 6. Химические свойства элементов II группы главной подгруппы
- 7. Химические свойства элементов II группы главной подгруппы
- 8. Химические свойства оксидов BeO – амфотерный оксид MgO CaO SrO Основные оксиды BaO Оксид кальция СаО
- 9. Взаимодействие оксида кальция с водой ( гашение извести)
- 10. Химические свойства гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания
- 13. Напишите уравнения реакций с помощью которых можно осуществить превращения: Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4 Be→BeO→BeCl2→Be(OH)2→Na2BeO2 ↓ BeSO4
- 15. Скачать презентацию











 Цікаві факти про Харчові добавки Презентація Гладкіх Ксенії Учениці 11-В класу
Цікаві факти про Харчові добавки Презентація Гладкіх Ксенії Учениці 11-В класу  Кинетика сложных реакций
Кинетика сложных реакций Карбоновые кислоты
Карбоновые кислоты Аккумуляторы и их устройство
Аккумуляторы и их устройство Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Оксиды. Определение, состав, номенклатура, классификация и структурные формулы
Оксиды. Определение, состав, номенклатура, классификация и структурные формулы Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Минералы. Значение минералов и задачи минералогии
Минералы. Значение минералов и задачи минералогии Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Спирты. Классификация спиртов
Спирты. Классификация спиртов Лужні метали Підготувала: Анна Сідорова
Лужні метали Підготувала: Анна Сідорова  Загрязнение продуктов питания примесями, мигрирующими из оборудования, инвентаря, тары и упаковочных материалов
Загрязнение продуктов питания примесями, мигрирующими из оборудования, инвентаря, тары и упаковочных материалов Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Химический элемент медь
Химический элемент медь Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней.
Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней. Диазины. Характеристика диазинов. (Лекция 8)
Диазины. Характеристика диазинов. (Лекция 8) Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Сульфат меди
Сульфат меди Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Путешествие в мир углеводородов нефти
Путешествие в мир углеводородов нефти Звезды Лейденфроста
Звезды Лейденфроста Фотодыхание
Фотодыхание Уголь. Виды угля
Уголь. Виды угля Алюминий и его соединения
Алюминий и его соединения Растворы и их классификация
Растворы и их классификация МЫШЬЯК Презентацию подготовила Юдайханова Юлия Ученица 11 класса В
МЫШЬЯК Презентацию подготовила Юдайханова Юлия Ученица 11 класса В