Содержание
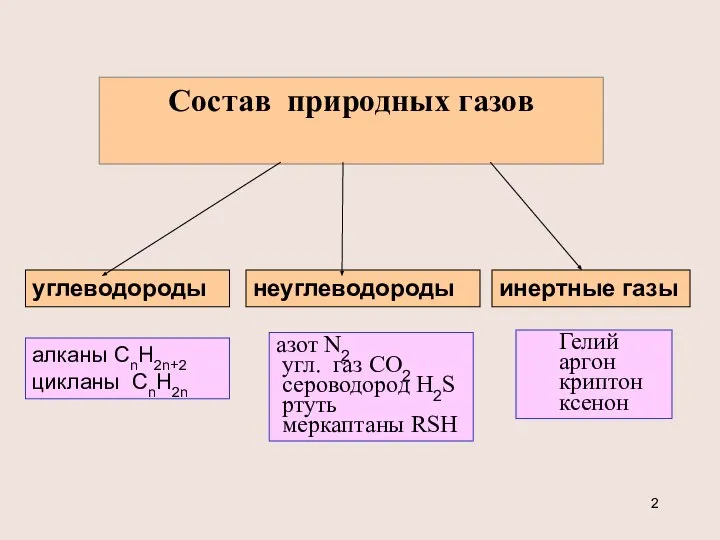
- 2. Состав природных газов углеводороды неуглеводороды инертные газы алканы CnH2n+2 цикланы CnH2n азот N2 угл. газ СО2
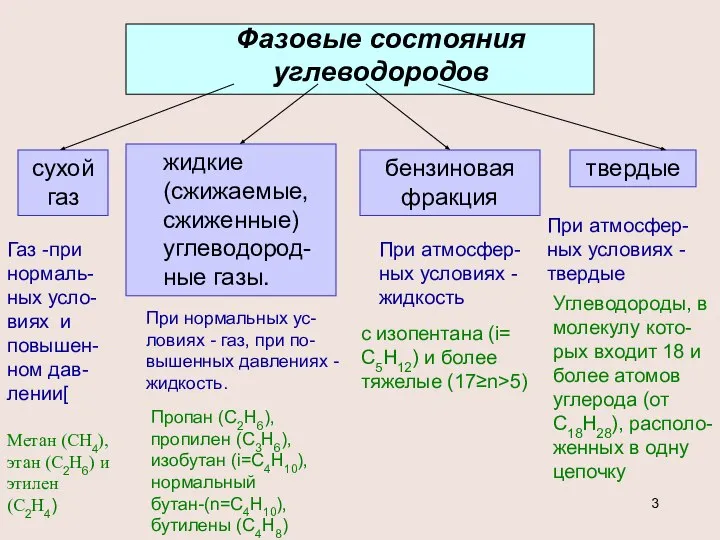
- 3. Фазовые состояния углеводородов сухой газ жидкие (сжижаемые, сжиженные) углеводород-ные газы. бензиновая фракция твердые Метан (СН4), этан
- 4. Типовые процессы подготовки газа к транспорту гидромеханические процессы теплообменные процессы массобменные или диффузионные процессы. Массопередача –
- 5. общие признаки массобменных процессов Они применяются для разделения смесей. В любом процессе участвуют как минимум две
- 6. Способы выражения составов смесей и связь между ними.
- 7. Взаимосвязь между способами выражения составов
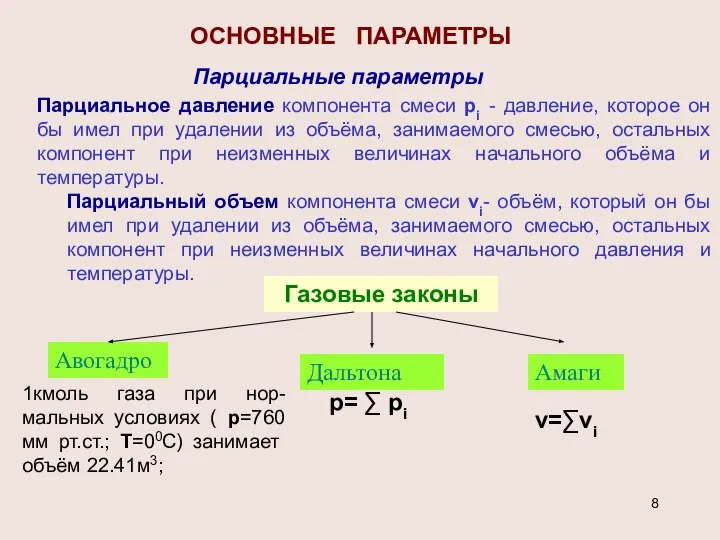
- 8. ОСНОВНЫЕ ПАРАМЕТРЫ Парциальные параметры Парциальное давление компонента смеси pi - давление, которое он бы имел при
- 9. Параметры газовых смесей плотность газа в нормальных условиях ρст= М/22.41, кг/м3 ; относительная плотность -ρ -
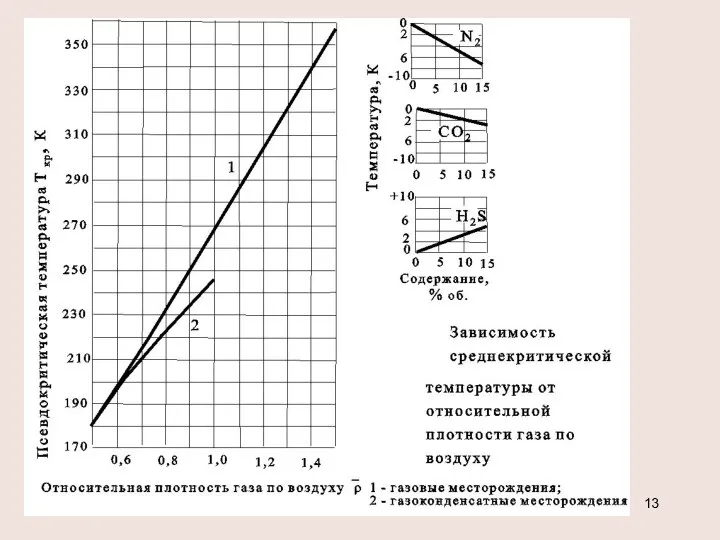
- 10. Критические и приведённые термодинамические параметры Критическим состоянием называется такое состояние вещества, при котором плотность вещества и
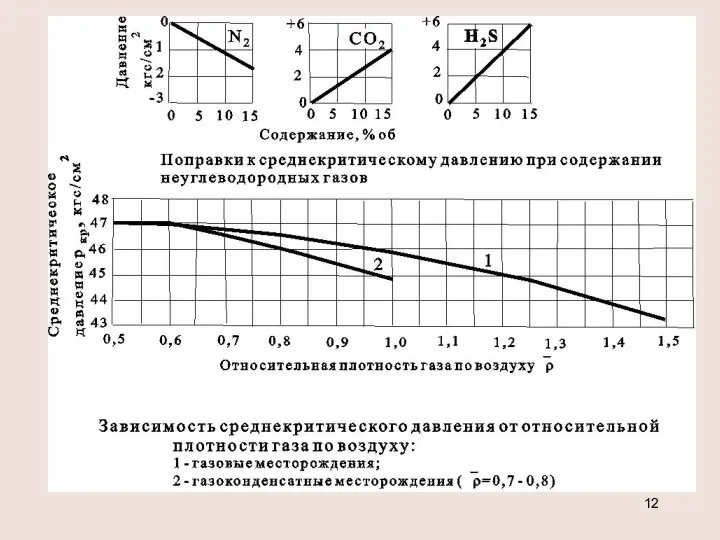
- 11. Определение критических параметров смеси pкр=∑(Pкрi xi) , Ткр =∑(Tкрi xi) давление в кгс/см2 - температура в
- 14. Уравнения состояния природных газов Уравнением состояния называется аналитическая зависимость между термодинамическими параметрами, описываю-щими поведение вещества. Совершенный
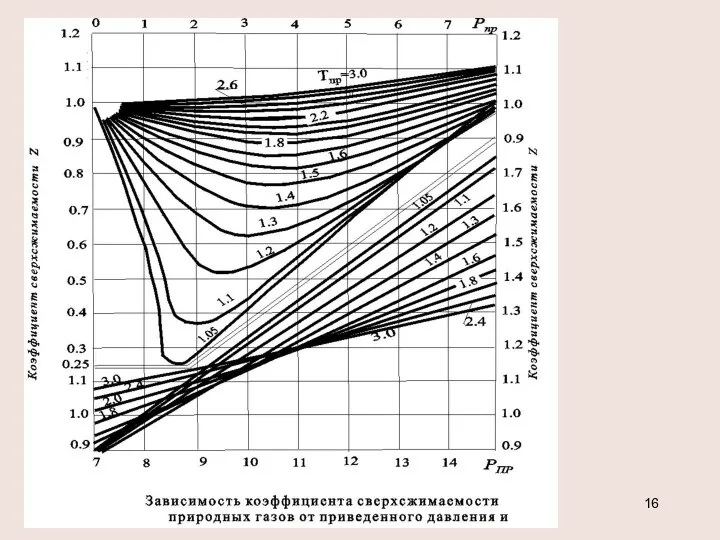
- 15. Обобщенное уравнение состояния р=z ρR T Коэффициент сверхсжимаемости z является функцией приведенных значений давления рпр, температуры
- 18. Скачать презентацию









 Азотная кислота и ее соли - нитраты
Азотная кислота и ее соли - нитраты Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой
Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой Білки. Властивості та функції
Білки. Властивості та функції Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Изомеры и гомологи
Изомеры и гомологи Аттестационная работа. Проектные работы учащихся по химии. Эссе
Аттестационная работа. Проектные работы учащихся по химии. Эссе Азот
Азот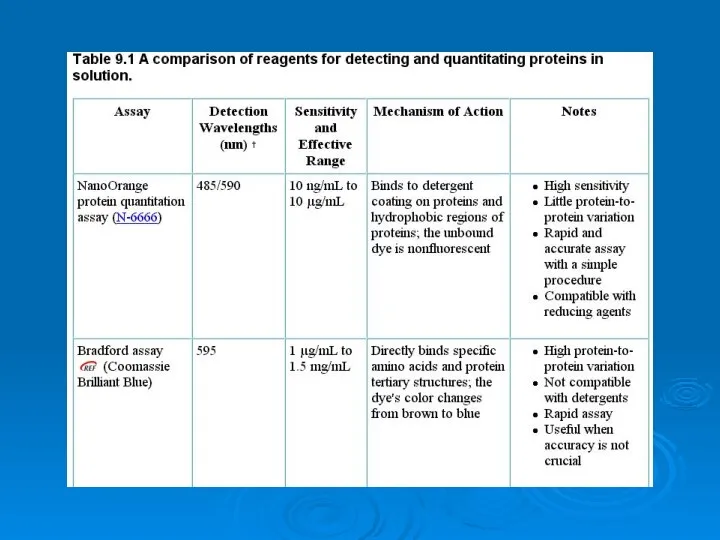 Analysis of proteins
Analysis of proteins Chemical reactions. (Chapter 5)
Chemical reactions. (Chapter 5) Чистые вещества и смеси
Чистые вещества и смеси Этот удивительный песок
Этот удивительный песок Методи визначення хімічного складу ґрунту
Методи визначення хімічного складу ґрунту  Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2
Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2 Презентация по Химии "Польза жиров" - скачать смотреть
Презентация по Химии "Польза жиров" - скачать смотреть  Воспламенение (зажигание) газовых смесей
Воспламенение (зажигание) газовых смесей Презентация по Химии "Вещества – экорегуляторы в природе" - скачать смотреть
Презентация по Химии "Вещества – экорегуляторы в природе" - скачать смотреть  Химические волокна
Химические волокна Предмет органической химии
Предмет органической химии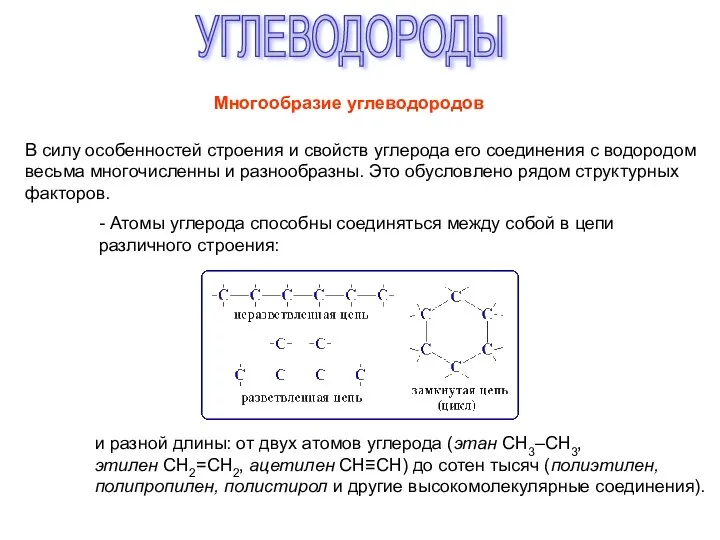 Углеводороды. Многообразие углеводородов
Углеводороды. Многообразие углеводородов Углерод. Химические свойства
Углерод. Химические свойства Обмен аминокислот и белков
Обмен аминокислот и белков Жиры (триглицериды)
Жиры (триглицериды) В мире криссталлов
В мире криссталлов Химическая кинетика
Химическая кинетика Тема урока: Оксиды
Тема урока: Оксиды Составление химических формул бинарных соединений по степени окисления атомов
Составление химических формул бинарных соединений по степени окисления атомов Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Влияние pH на микроорганизмы
Влияние pH на микроорганизмы