Решение задач на примере идеальных моделей химических реакторов различного типа для гомогенных процессов
Содержание
- 2. Задание 1. Гомогенная жидкофазная реакция A+B→R+S протекает в двух отдельно стоящих и автономно работающих реакторах РИВ
- 3. Алгоритм решения задачи Степень превращения реагента А: ХА = (СА0 – СА)/СА0 . Кинетическое выражение для
- 4. Исходные данные для расчета: Дано: k = 5∙10-2 м3/кмоль ∙ сек СА0 =СВ0= 8∙10-2 кмоль/м3, СА
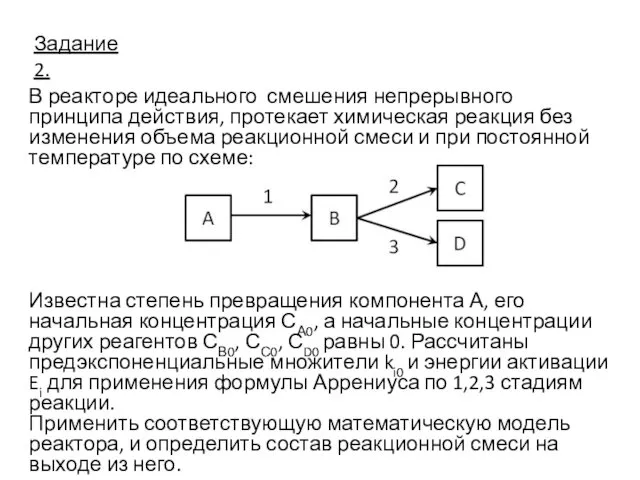
- 5. Задание 2. В реакторе идеального смешения непрерывного принципа действия, протекает химическая реакция без изменения объема реакционной
- 6. Основные выражения и ход выполнения задания Для РИС-Н в стационарном режиме: [(Сi0 – Сi)/τ]+ri =0 Скорость
- 7. Исходные данные для расчета: Дано: Т=2930К ХА=0,8 СА0 =2 кмоль/м3, СВ0= СС0= СD0 =0 k0 1=5,0
- 8. Задание 3. Жидкофазная реакция второго порядка А+В→R+S протекает при постоянной плотности реакционной смеси в каскаде, состоящем
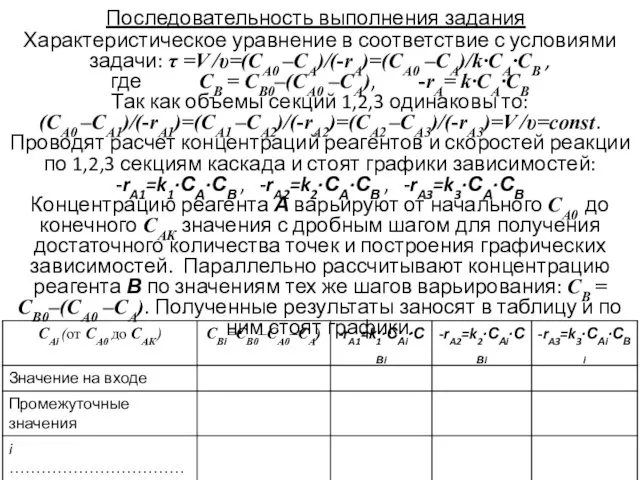
- 9. Последовательность выполнения задания Характеристическое уравнение в соответствие с условиями задачи: τ =V /υ=(СА0 –СА)/(-rA)=(СА0 –СА)/k∙CА∙СВ ,
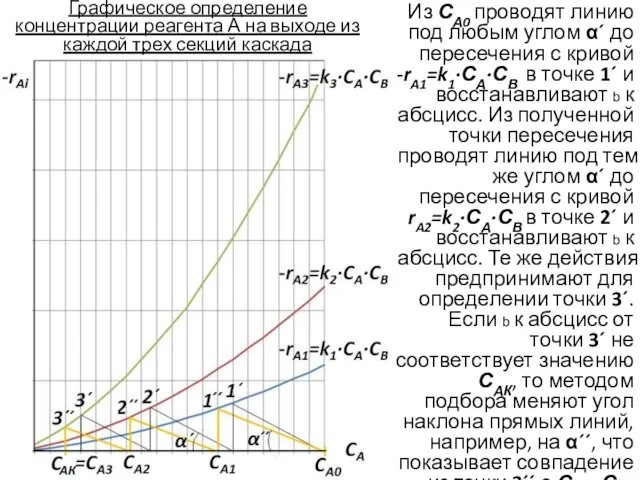
- 10. Графическое определение концентрации реагента А на выходе из каждой трех секций каскада Из СА0 проводят линию
- 12. Скачать презентацию






 Постмагматические процессы
Постмагматические процессы Биотрансформация чужеродных соединений в организме. (Лекция 5)
Биотрансформация чужеродных соединений в организме. (Лекция 5) Водороды
Водороды № 14.
№ 14.  Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ Презентация по Химии "Использование проектного метода при изучении химии" - скачать смотреть
Презентация по Химии "Использование проектного метода при изучении химии" - скачать смотреть  Атомы. Молекулы. Химические элементы
Атомы. Молекулы. Химические элементы Железо. Строение атома железа
Железо. Строение атома железа Каталитический крекинг
Каталитический крекинг Дефекты упорядочивающихся сплавов
Дефекты упорядочивающихся сплавов Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства ХИМИЯ КАК СРЕДСТВО ОСМЫСЛЕНИЯ РЕАЛЬНОЙ ЕДИНОЙ КАРТИНЫ МИРА
ХИМИЯ КАК СРЕДСТВО ОСМЫСЛЕНИЯ РЕАЛЬНОЙ ЕДИНОЙ КАРТИНЫ МИРА Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Липиды растений и их обмен
Липиды растений и их обмен Жартылый өткізгіштікке ие химиялық элементтер
Жартылый өткізгіштікке ие химиялық элементтер Презентация по Химии "Круговорот химических элементов в природе" - скачать смотреть
Презентация по Химии "Круговорот химических элементов в природе" - скачать смотреть  Аппаратура ионообменных процессов
Аппаратура ионообменных процессов Химическая связь
Химическая связь Углерод. Соединения углерода
Углерод. Соединения углерода Презентация по Химии "Кофеїн" - скачать смотреть бесплатно
Презентация по Химии "Кофеїн" - скачать смотреть бесплатно Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы
Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы Геохимия гидротермального процесса. Гидротермальные месторождения. (Лекция 8)
Геохимия гидротермального процесса. Гидротермальные месторождения. (Лекция 8) Круговорот воды в природе
Круговорот воды в природе Химические формулы
Химические формулы Удивительный мир кристаллов
Удивительный мир кристаллов Облучение. Радиационная окраска
Облучение. Радиационная окраска