Содержание
- 2. История открытия ртути Ртуть – 1 из 7 металлов древности. Она известна более 1500 лет до
- 3. Нахождение в природе Ртуть — относительно редкий элемент в Земной коре. В природе известно около 20
- 4. Строение атома ртути Ртуть — элемент побочной подгруппы II группы, VI периода периодической системы химических элементов
- 5. Физические свойства ртути Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Обладает
- 6. Химические свойства ртути Ртуть — малоактивный металл (см. ряд напряжений). При нагревании до 300 °C ртуть
- 7. Химические свойства ртути При нагревании ртути с серой образуется сульфид ртути(II): При обычных условиях реагирует с
- 8. Получение ртути Ртуть получают сжиганием киновари (cульфида ртути(II)). Этот способ применяли алхимики древности. HgS + O2
- 9. Применение ртути В медицине: медицинских термометрах (до 2 г ртути) Мертиолят как консервант для вакцин. Амальгаму
- 10. Применение ртути В технике: Парами ртути наполняются ртутно-кварцевые и люминесцентные лампы. Ртуть используется в датчиках положения.
- 11. В металлургии для получения целого ряда важнейших сплавов. Амальгамы золота и серебра, ранее широко использовались в
- 12. Токсикология ртути Ядовиты только пары́ и растворимые соединения ртути. Металлическая ртуть не оказывает существенного воздействия на
- 13. Исторический факт Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956
- 14. Соединения ртути HgO – твёрдое вещество жёлтого или красного цвета, легко разлагается при нагревании. Все растворимые
- 16. Скачать презентацию













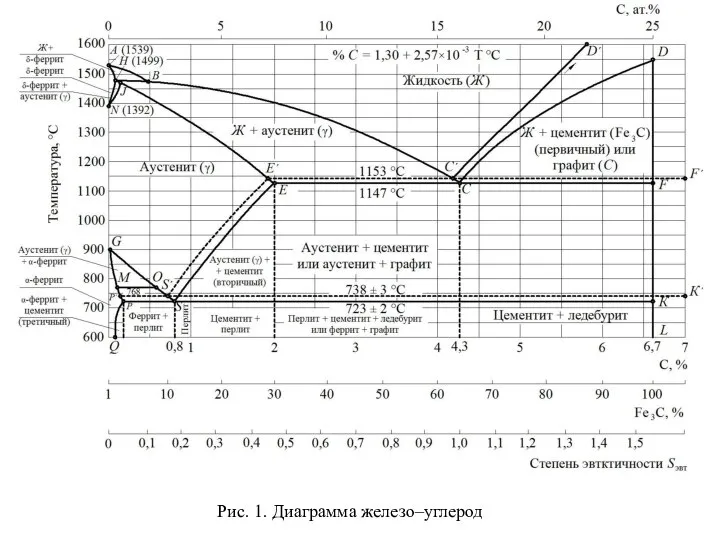 Чугуны и стали
Чугуны и стали Круговорот азота в природе
Круговорот азота в природе Презентация по Химии "Проблема вмісту нітратів в продуктах харчування" - скачать смотреть бесплатно
Презентация по Химии "Проблема вмісту нітратів в продуктах харчування" - скачать смотреть бесплатно Непредельные углеводороды ряда этилена = алкены
Непредельные углеводороды ряда этилена = алкены Фармакодинамика лекарственных средств
Фармакодинамика лекарственных средств Материаловедение. Основы металловедения
Материаловедение. Основы металловедения Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж
Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж Применение центрифугирования
Применение центрифугирования Структурная механика композитов. Композитный монослой
Структурная механика композитов. Композитный монослой Теория электролитической диссоциации
Теория электролитической диссоциации Презентация по Химии "Презентация Пищевые цепи" - скачать смотреть
Презентация по Химии "Презентация Пищевые цепи" - скачать смотреть  1oe_zanyatie (1)
1oe_zanyatie (1) МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор
МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно
Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно Синтез высокомолекулярных соединений
Синтез высокомолекулярных соединений Жидкие кристаллы
Жидкие кристаллы Подготовка к ГИА. А5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений
Подготовка к ГИА. А5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений Аміни. Метиламін
Аміни. Метиламін Презентация для класса Способы получения натрия
Презентация для класса Способы получения натрия  Полиэтилен высокого давления
Полиэтилен высокого давления Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф
Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф Коллоидные ПАВ. Солюбилизация
Коллоидные ПАВ. Солюбилизация Залежність фізичних властивостей речовин від типу кристалічних ґраток
Залежність фізичних властивостей речовин від типу кристалічних ґраток Химическая связь
Химическая связь Дисперсные системы
Дисперсные системы Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья
Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья  Вугілля і продукти його переробки.Вуглеводнева сировина й охорона довкілля.
Вугілля і продукти його переробки.Вуглеводнева сировина й охорона довкілля.  Минералы и их свойства
Минералы и их свойства