Содержание
- 2. Из истории. Знаете ли вы, что еще в IV в. До н. э. люди умели изготавливать
- 3. Физические свойства Низшие спирты – это жидкости, хорошо растворимые в воде, без цвета, с запахом. Высшие
- 4. Особенность физических свойств: агрегатное состояние. Метиловый спирт (первый представитель гомологического ряда спиртов)– жидкость. Может быть у
- 5. Особенность физических свойств: растворимость в воде. Низшие спирты растворимы в воде, высшие – не растворимы. Почему?
- 6. Особенность физических свойств: контракция. Почему при решении расчетных задач никогда не пользуются объемом, а только массой?
- 7. Спирты – это кислоты? Спирты реагируют со щелочными металлами. При этом атом водорода гидроксильной группы замещается
- 8. Дружба с ГАИ. Спирты дружат с ГАИ? Но каким образом! Вас когда - нибудь останавливал инспектор
- 9. Отдаем воду 1. Отнятие воды – дегидротация может быть внутримолекулярная, если температура больше 140 градусов. При
- 10. Отдаем воду 2 Если температуру уменьшить, а катализатор оставить тот – же, то пройдет межмолекулярная дегидротация.
- 11. Реакция с галогеноводородами. Эта реакция обратима и требует катализатора – концентрированной серной кислоты. СН3 – СН2
- 13. Скачать презентацию










 Повітря. Основні забруднювачі: теплоенергетика, кольорова та чорна металургія, використання фреонів, підприємства будматеріалі
Повітря. Основні забруднювачі: теплоенергетика, кольорова та чорна металургія, використання фреонів, підприємства будматеріалі Проблемы химической безопасности в России
Проблемы химической безопасности в России Классификация кислот
Классификация кислот Химические свойства металлов
Химические свойства металлов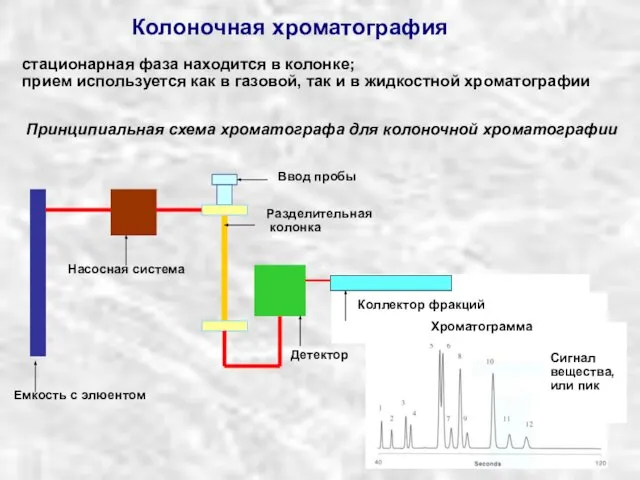 Колоночная хроматография
Колоночная хроматография Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Оксиген як хімічний елемент
Оксиген як хімічний елемент Растворение. Растворы
Растворение. Растворы Методы анализа молочных продуктов с использованием электрофореза. Электрофоретический метод в биохимии
Методы анализа молочных продуктов с использованием электрофореза. Электрофоретический метод в биохимии Проект: «Мои любимые опыты с содой и уксусом»
Проект: «Мои любимые опыты с содой и уксусом» Строение и свойства веществ
Строение и свойства веществ Общая характеристика углерода
Общая характеристика углерода Свинец. Полезный металл, яд и глобальный загрязнитель
Свинец. Полезный металл, яд и глобальный загрязнитель Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2)
Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2) Титан және оның қорытпалары. Титаннан жасалған құралдар
Титан және оның қорытпалары. Титаннан жасалған құралдар Коллекция учебных динамических слайдов по химии (8 класс)
Коллекция учебных динамических слайдов по химии (8 класс) Правила безпечного використання засобів побутової хімії Підготував ліцеїст групи Е-2 Ліщук Назарій
Правила безпечного використання засобів побутової хімії Підготував ліцеїст групи Е-2 Ліщук Назарій  Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация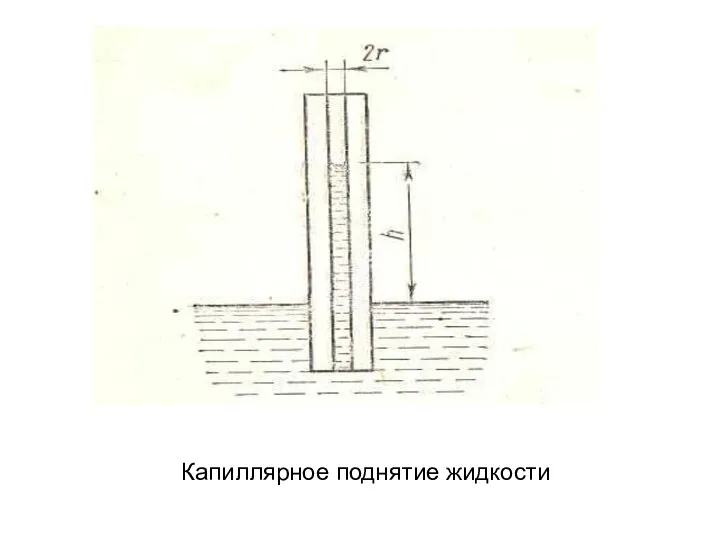 Капиллярное поднятие жидкости
Капиллярное поднятие жидкости Сульфат меди
Сульфат меди Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Презентация Палладий
Презентация Палладий  Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Алюминий
Алюминий Великие химики России
Великие химики России Учение о растворах
Учение о растворах Типы химических реакций Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск
Типы химических реакций Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск  Органическая геохимия
Органическая геохимия