Содержание
- 2. Нахождение в природе В вулканических газах, В месторождениях нефти и газа, В водах минеральных источников, например,
- 3. Физические свойства Бесцветный газ с характерным запахом гниющего белка В полтора раза тяжелее воздуха Снижается при
- 4. 6е 2Н₂S+3O₂=2H₂O+2SО₂ (при избытке кислорода) S (-2) ? S (+4) - восстановитель (отдаёт 6 электронов) O₂
- 5. Окисление до свободной серы, оседающей на чашке в виде желтого налета: 4е 2Н₂S+O₂=2H₂O+2S (при недостатке кислорода)
- 6. При высокой температуре сера взаимодействует с водородом, образуя газ сероводород: 2е S+H₂=H₂S↑ S (0) ? S
- 7. Реагирует с щелочами: H₂S + 2NaOH = Na₂S +2H₂O (средняя соль при избытке NaOH) H₂S +
- 8. Сероводород реагирует также со многими другими окислителями: 3H₂S + 4HClO₃ = 3H₂SO₄ реакция ионного обмена 2H₂S
- 9. Взаимодействие с солями свинца H₂S + Pb(NO₃)₂=PbS + 2HNO₃ сульфид свинца (чёрный осадок) Качественная реакция на
- 10. Получение сероводорода действием разбавленных кислот на сернистые металлы, например на сульфид железа: FeS + 2HCl =
- 12. Скачать презентацию





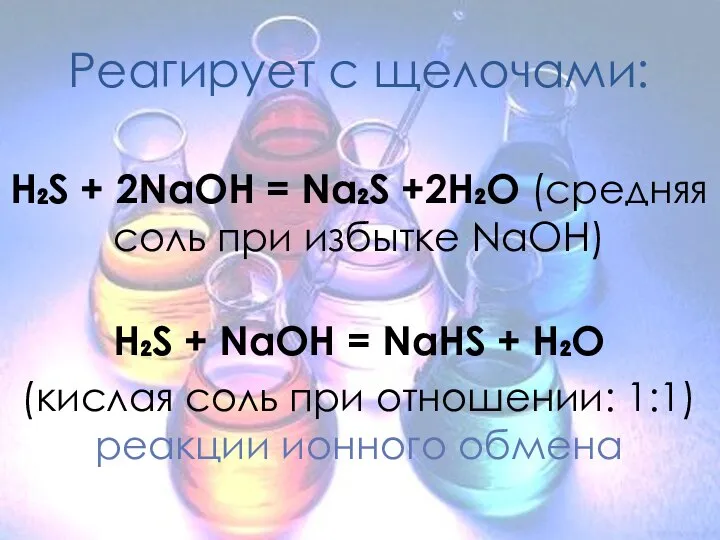


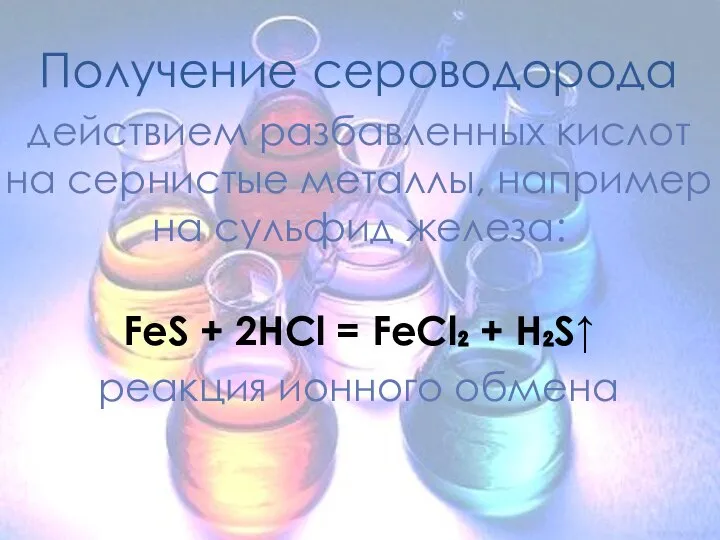
 Амилаза. Строение амилазы
Амилаза. Строение амилазы Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Коррозия металлов
Коррозия металлов Химия и здоровье человека
Химия и здоровье человека Цитохромы P-450, b-5
Цитохромы P-450, b-5 Количество вещества. Моль. Число Авагадро
Количество вещества. Моль. Число Авагадро Презентация по теме «Полисахариды. Крахмал и целлюлоза» Автор: Пономарева О.Ю. учитель химии МОУ «Куртамышская СОШ № 2» 2009г
Презентация по теме «Полисахариды. Крахмал и целлюлоза» Автор: Пономарева О.Ю. учитель химии МОУ «Куртамышская СОШ № 2» 2009г 10 класс Углеводороды. Применение природных источников углеводородов и продуктов их переработки. Презентация: Учителя химии
10 класс Углеводороды. Применение природных источников углеводородов и продуктов их переработки. Презентация: Учителя химии  Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты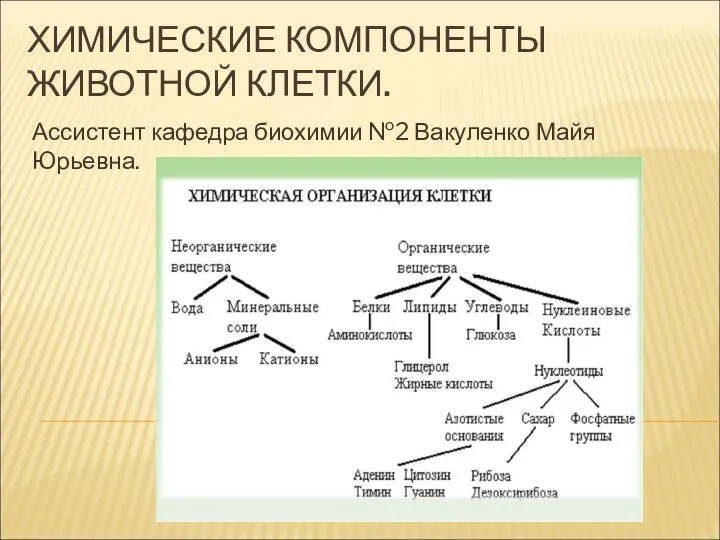 Химические компоненты животной клетки
Химические компоненты животной клетки Пластмассы
Пластмассы Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4)
Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4) Понятие биогенности химических элементов
Понятие биогенности химических элементов Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Бытовая химия в квартире
Бытовая химия в квартире Органические вяжущие. (Лекция 12)
Органические вяжущие. (Лекция 12) Биохимия крови
Биохимия крови Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства
Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства Алкадиены и каучуки
Алкадиены и каучуки Лекарственное растительное сырье, содержащее витамины
Лекарственное растительное сырье, содержащее витамины Atomic structure. Introduction
Atomic structure. Introduction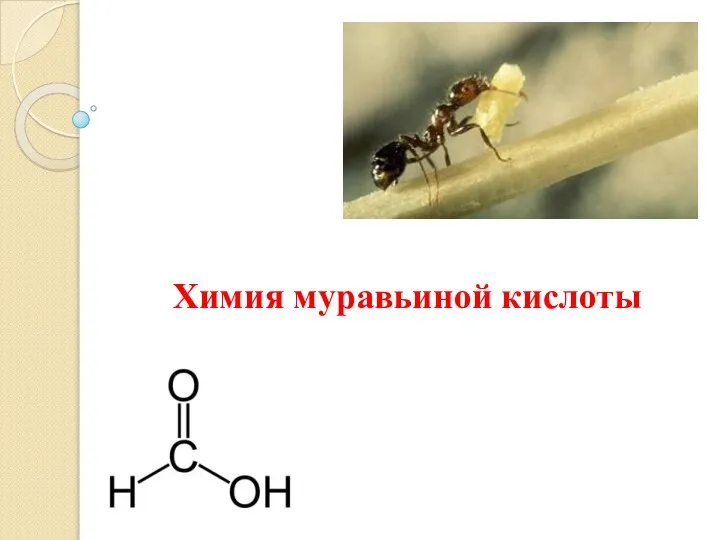 Химия муравьиной кислоты
Химия муравьиной кислоты Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Кальций(Ca)
Кальций(Ca) Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Алкени, їх ізомерія та номенклатура
Алкени, їх ізомерія та номенклатура Теория строения
Теория строения