Содержание
- 2. v=±Δc∕Δt; ΔC=с2-с1 ; Δt=t2-t1 ; Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или
- 3. Гомогенные реакции Это реакции идущие между веществами в неоднородной среде. Например, на поверхности соприкосновения твердого вещества
- 4. Гомогенные реакции Это реакции протекающие в однородной среде(нет поверхности раздела реагирующих веществ). Например в смеси газов
- 5. Зависимость скорости химических реакций от концентрации реагирующих веществ mA + nB=pC + qD Скорость реакции прямо
- 6. Зависимость скорости реакции от температуры При повышении температуры на каждые 10◦С скорость реакции увеличивается в 2-4
- 7. Зависимость скорости реакции от природы реагирующих веществ Взаимодействие цинка с соляной и уксусной кислотой: 2HCl +
- 8. 5.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной
- 9. Зависимость скорости реакции от катализатора Вещества, которые изменяют скорость химической реакции, оставаясь к концу её неизменными,
- 11. Скачать презентацию








 Металлы и сплавы
Металлы и сплавы ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии
ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen Алкины. 10 класс
Алкины. 10 класс Физические свойства элементов
Физические свойства элементов Гидролиз. Методы его получения и применения
Гидролиз. Методы его получения и применения Ученые химики. Выполнила ученица 10 кл. Трофимова Настя
Ученые химики. Выполнила ученица 10 кл. Трофимова Настя Жидкостно-сцинтилляционная спектроскопия
Жидкостно-сцинтилляционная спектроскопия Многоатомные спирты
Многоатомные спирты Алканы. Гомологи, изомеры, номенклатура.
Алканы. Гомологи, изомеры, номенклатура.  Валидация титриметрических методик анализа
Валидация титриметрических методик анализа Электролитическая диссоциация
Электролитическая диссоциация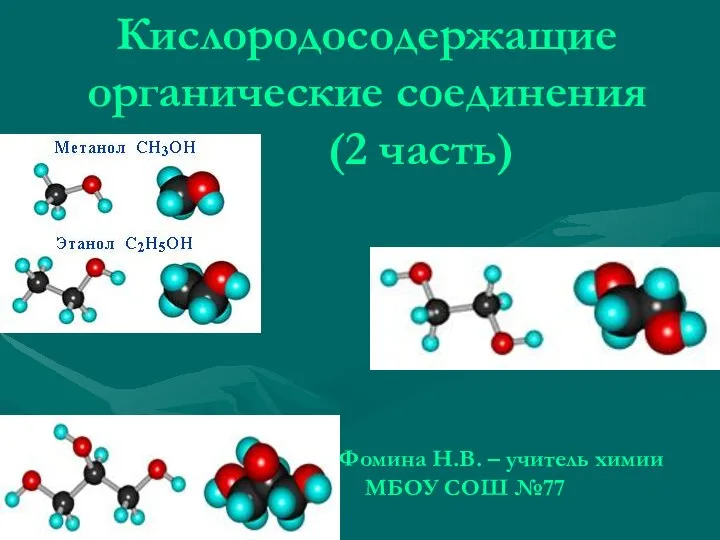 Кислородосодержащие органические соединения (2 часть)
Кислородосодержащие органические соединения (2 часть) Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Синергизм и синергические системы
Синергизм и синергические системы Химические реакции. Типы химических реакций
Химические реакции. Типы химических реакций Требование к оформлению отчета лабораторной работы
Требование к оформлению отчета лабораторной работы ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ПОДГРУППЫ КИСЛОРОДА
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ПОДГРУППЫ КИСЛОРОДА  Моделирование химических процессов
Моделирование химических процессов Поверхностное упрочнение деталей. (Лекция 11)
Поверхностное упрочнение деталей. (Лекция 11) Окисно-відновні процеси
Окисно-відновні процеси Кислород, его общая характеристика, нахождение в природе и получение (8 класс)
Кислород, его общая характеристика, нахождение в природе и получение (8 класс) «Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к
«Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к Штучні і синтетичні волокна
Штучні і синтетичні волокна  Современные и новейшие материалы
Современные и новейшие материалы Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна
Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна