Содержание
- 2. План 1. Загальна характеристика спиртів. 2. Гомологічний ряд. 3. Будова молекули. 4. Ізомерія та класифікація. 5.
- 3. Спирти - Речовини, що мають одну або декілька гідроксильних груп приєднаних до вуглеводневого радикалу.
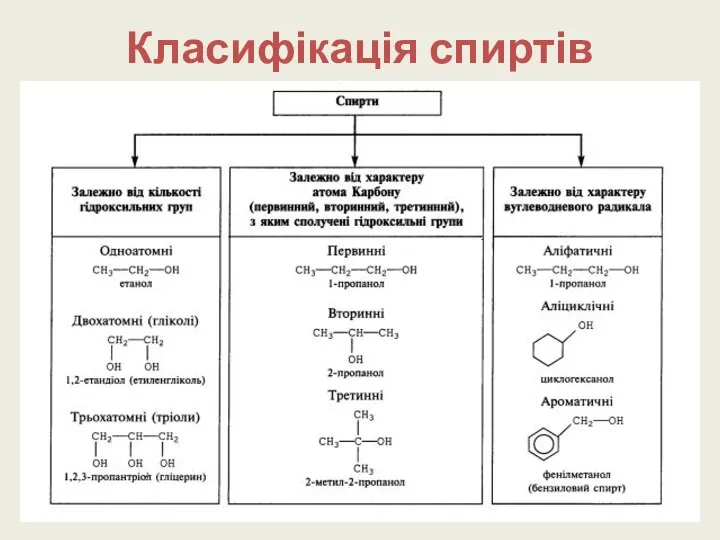
- 4. Класифікація спиртів
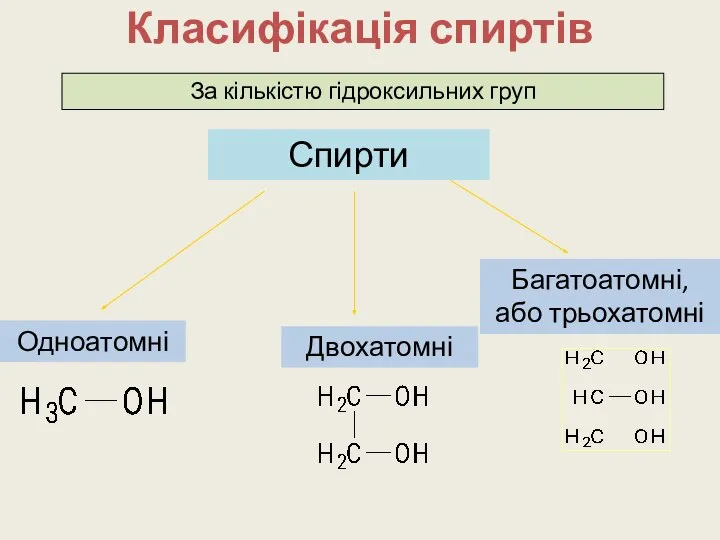
- 5. Класифікація спиртів Одноатомні Двохатомні Багатоатомні, або трьохатомні Спирти За кількістю гідроксильних груп
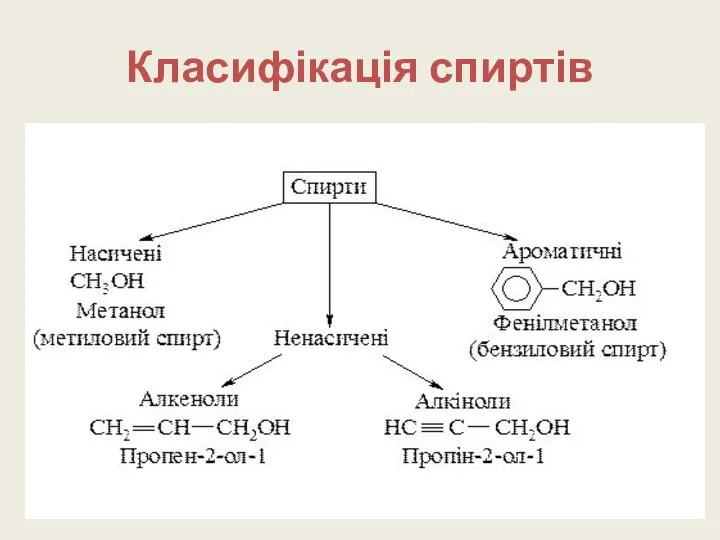
- 6. Класифікація спиртів
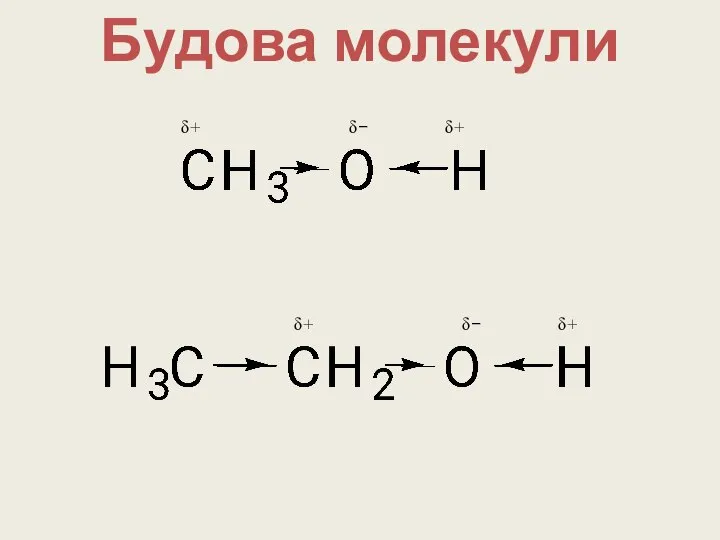
- 7. Будова молекули
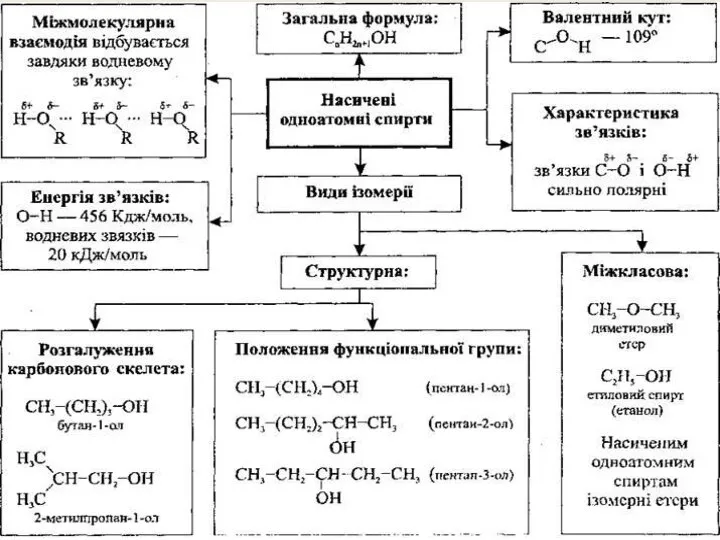
- 9. ІЗОМЕРІЯ СПИРТІВ
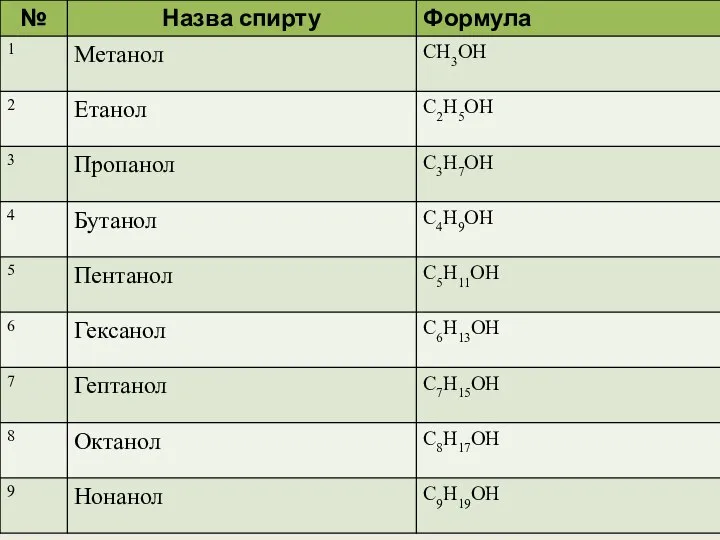
- 10. НАЗВА СПИРТІВ НАЗВА АЛКАНУ І СУФІКС ОЛ МЕТАН + ОЛ = МЕТАНОЛ ЕТАН + ОЛ =
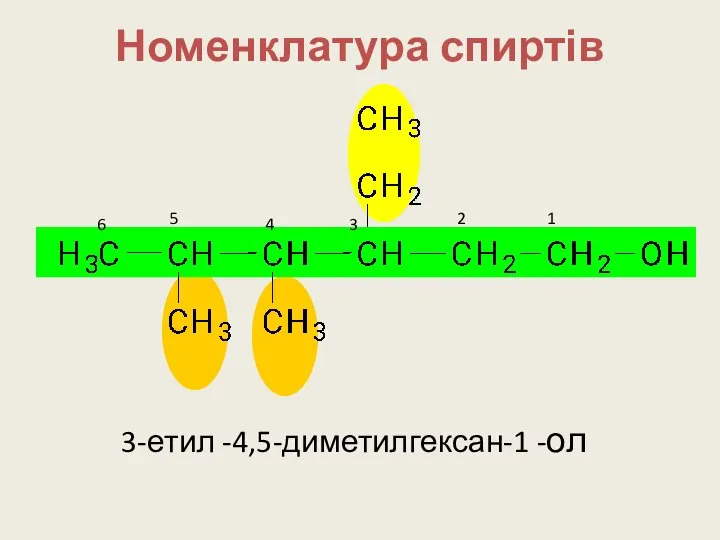
- 11. Номенклатура (IUPAC) Визначають найдовший вуглецевий ланцюг. Знаходять з якого боку найближче знаходиться група -ОН. Нумерують ланцюг
- 12. Номенклатура спиртів 1 3-етил -4,5-диметилгексан-1 -ол 2 3 4 5 6
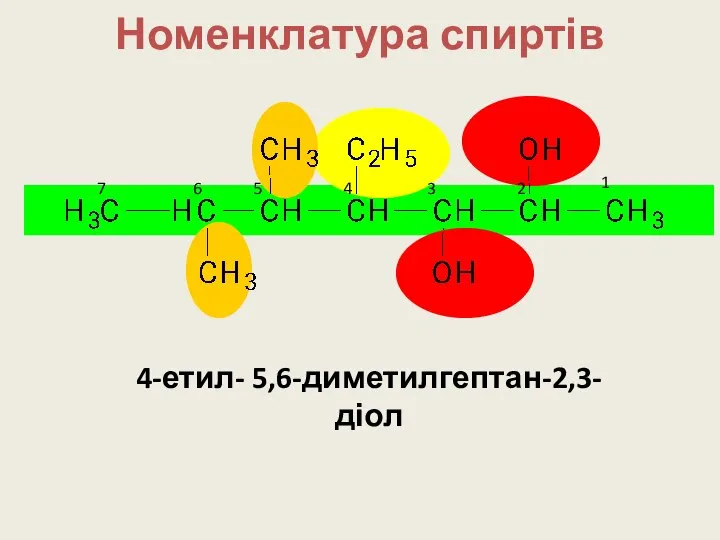
- 13. Номенклатура спиртів 1 2 3 4 5 6 7 4-етил- 5,6-диметилгептан-2,3-діол
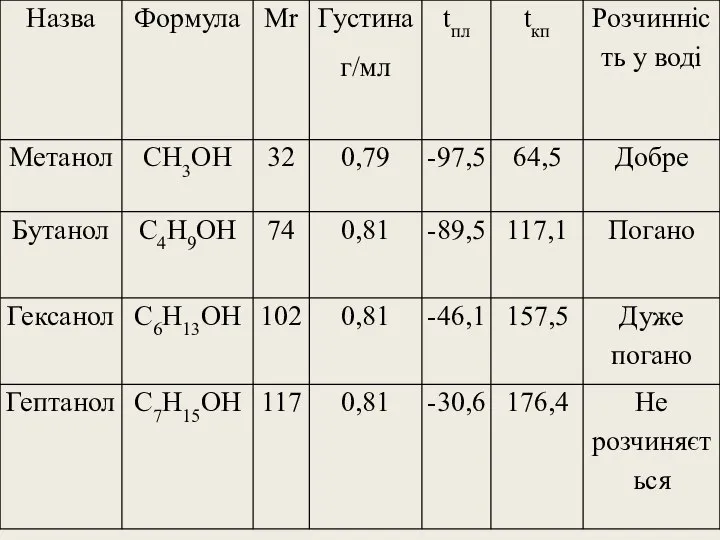
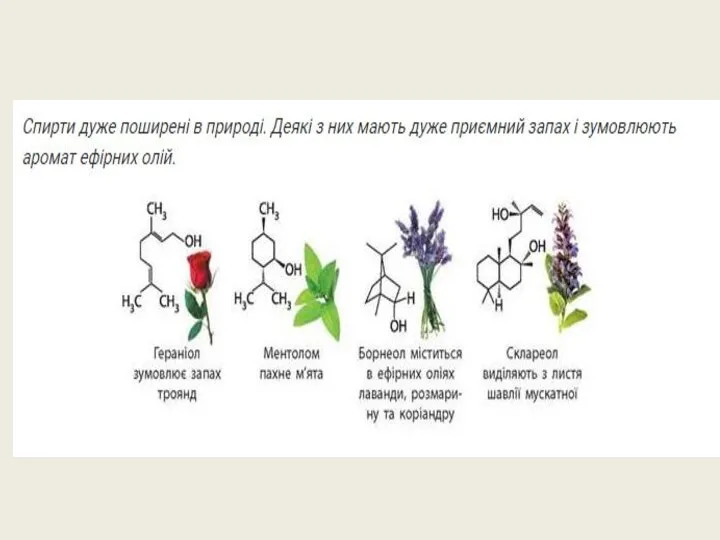
- 14. Фізичні властивості спиртів
- 17. Хімічні властивості
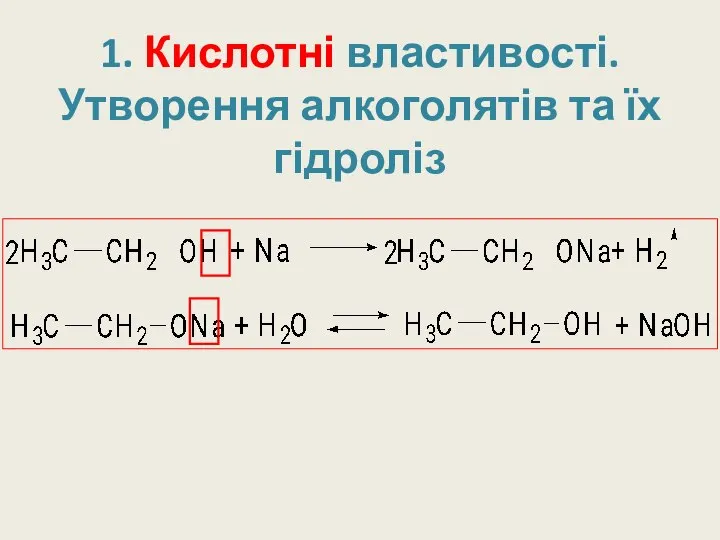
- 18. 1. Кислотні властивості. Утворення алкоголятів та їх гідроліз
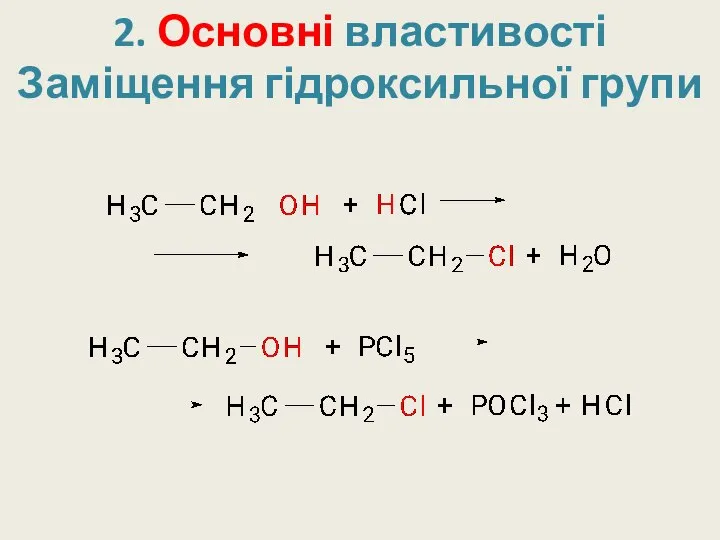
- 19. 2. Основні властивості Заміщення гідроксильної групи
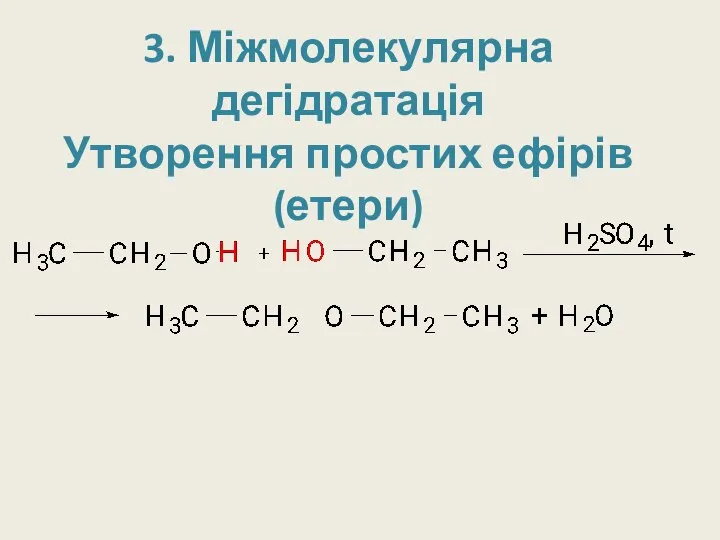
- 20. 3. Міжмолекулярна дегідратація Утворення простих ефірів (етери)
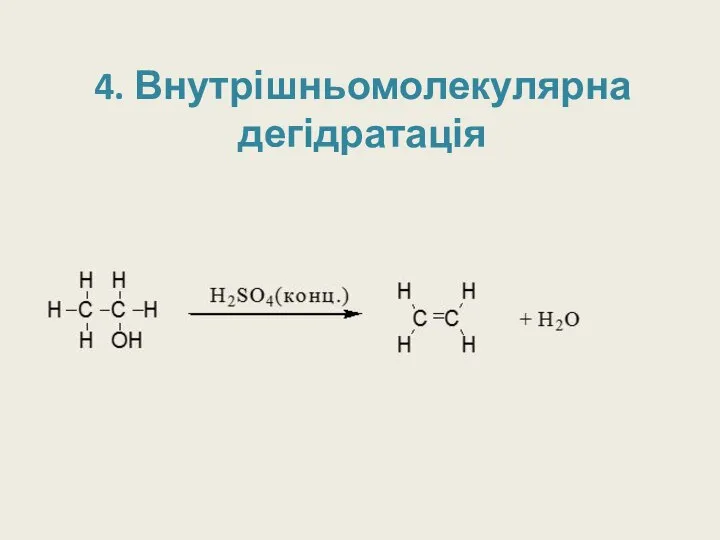
- 21. 4. Внутрішньомолекулярна дегідратація
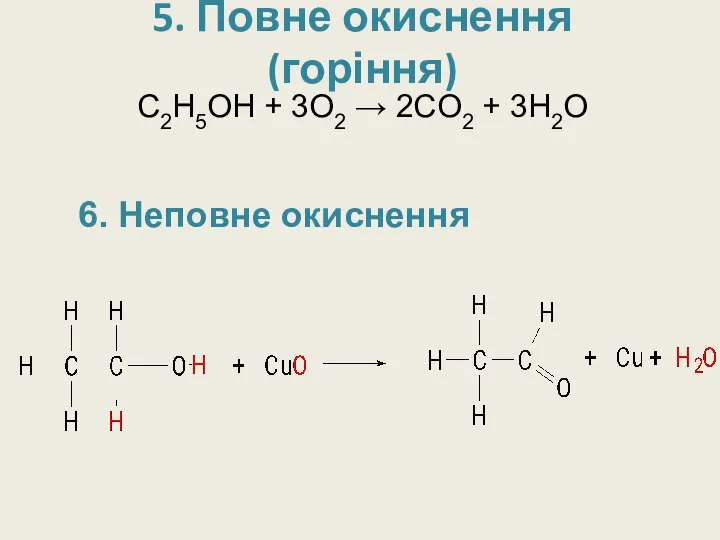
- 22. 5. Повне окиснення (горіння) С2H5OH + 3O2 → 2CO2 + 3H2O 6. Неповне окиснення
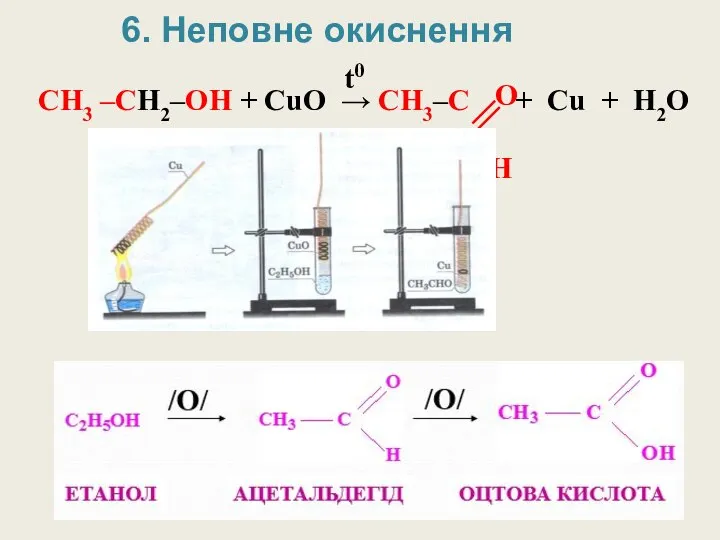
- 23. CH3 –CH2–OH + CuO → CH3–C + Cu + H2O t0 O H 6. Неповне окиснення
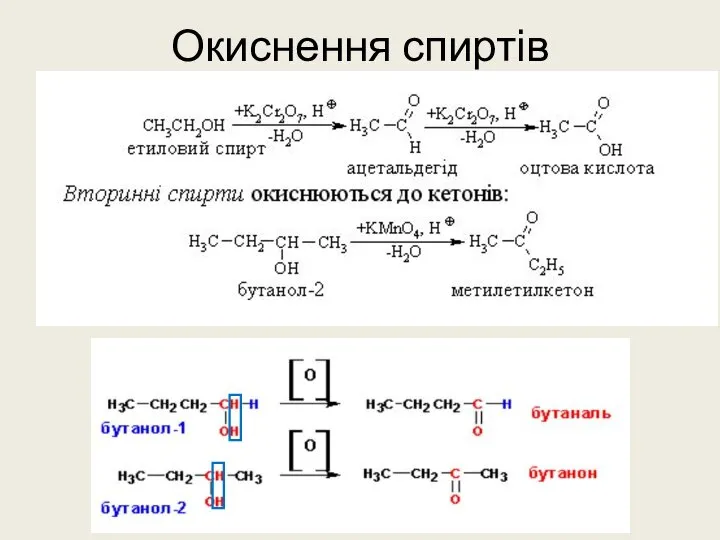
- 24. Окиснення спиртів
- 25. Зміна кислотних властивостей спиртів полярність зв’язку О–Н навпаки зменшуєть-ся, що і обумовлює зменшення кислотних властивостей. Замісники
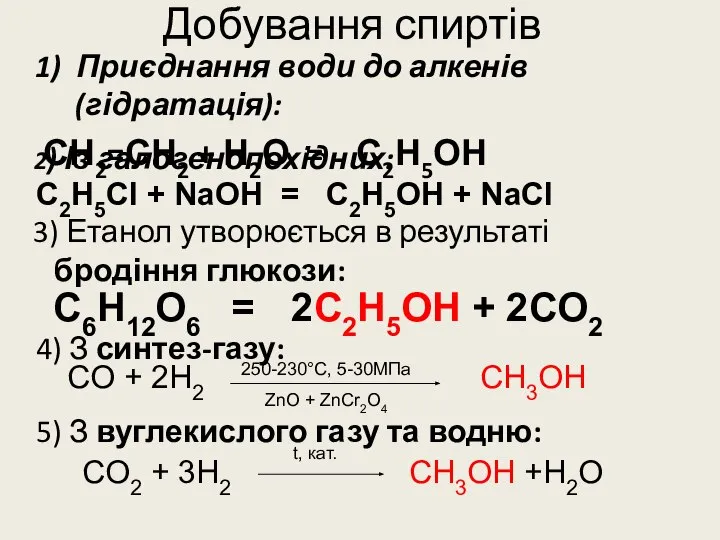
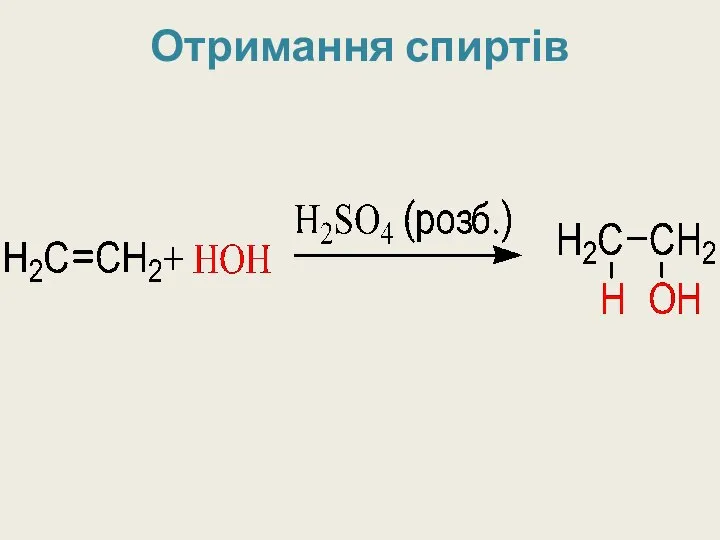
- 27. Добування спиртів 1) Приєднання води до алкенів (гідратація): СН2=СН2 + Н2О = С2Н5ОН 2) Із галогенопохідних:
- 28. Отримання спиртів
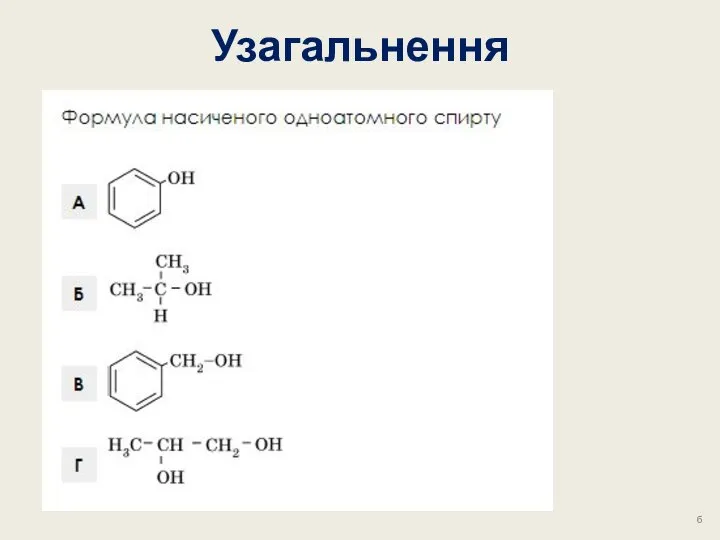
- 29. Узагальнення г
- 30. Узагальнення в
- 31. Узагальнення а
- 32. Узагальнення в
- 33. Узагальнення 353
- 34. Узагальнення в
- 35. Узагальнення б
- 36. Узагальнення гадв
- 37. Узагальнення в
- 38. Узагальнення г
- 39. Узагальнення г
- 40. Узагальнення в
- 41. Узагальнення а
- 42. а
- 43. Узагальнення
- 45. Скачать презентацию






















 Квантовая механика – теоретическая основа современной химии
Квантовая механика – теоретическая основа современной химии Химия и здоровье
Химия и здоровье Углехимическое сырьё К нему относят: торф, бурые угли, антрацит, горючие сланцы – ископаемые твердые топлива.
Углехимическое сырьё К нему относят: торф, бурые угли, антрацит, горючие сланцы – ископаемые твердые топлива.  Алкалоиды, производные хинолина, изохинолина. Общая характеристика, методы анализа
Алкалоиды, производные хинолина, изохинолина. Общая характеристика, методы анализа Химическая формула. Относительная атомная и относительная молекулярная массы
Химическая формула. Относительная атомная и относительная молекулярная массы Кевлар. Структура кевлара
Кевлар. Структура кевлара Білки (протеїни)
Білки (протеїни) Липиды; классификация; строение; значение для жизнедеятельности организмов
Липиды; классификация; строение; значение для жизнедеятельности организмов Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Удивительная вода и ее свойства
Удивительная вода и ее свойства Глюкоза – это спирт, альдегид или альдегидоспирт?
Глюкоза – это спирт, альдегид или альдегидоспирт? Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Кальцит
Кальцит Презентация Сульфатредуцирующие бактерии
Презентация Сульфатредуцирующие бактерии Урок-исследование: факторы влияющие на скорость химических реакций
Урок-исследование: факторы влияющие на скорость химических реакций История открытия стекла
История открытия стекла «Созвездие талантов» Игра-зачет по теме «Основные классы неорганической химии» 8 класс Автор: Рязкова Н.А., учитель химии М
«Созвездие талантов» Игра-зачет по теме «Основные классы неорганической химии» 8 класс Автор: Рязкова Н.А., учитель химии М Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Коллигативные свойства растворов
Коллигативные свойства растворов Оптические свойства дисперсных систем
Оптические свойства дисперсных систем Химия s-элементов. Общая характеристика
Химия s-элементов. Общая характеристика Презентация по Химии "Химические антонимы" - скачать смотреть
Презентация по Химии "Химические антонимы" - скачать смотреть  Презентация Оксиды углерода
Презентация Оксиды углерода Физико-химические методы анализа. Общая характеристика. Особенности и области применения
Физико-химические методы анализа. Общая характеристика. Особенности и области применения Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Основания
Основания Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4)
Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4) Оценка образовательных достижений школьников при личностно-ориентированном обучении химии
Оценка образовательных достижений школьников при личностно-ориентированном обучении химии