Содержание
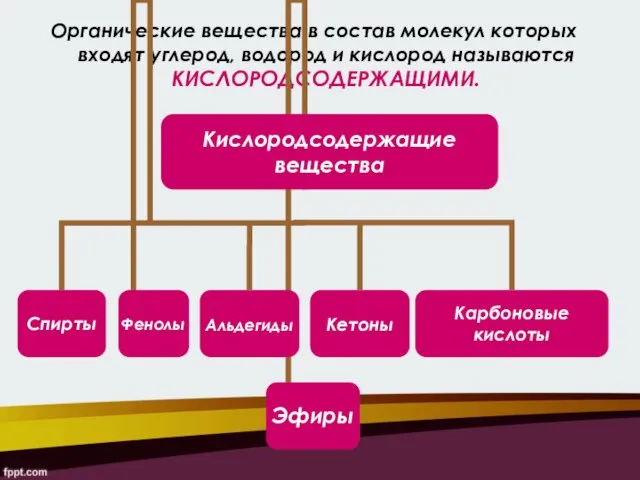
- 2. Органические вещества в состав молекул которых входят углерод, водород и кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.
- 3. Спирты – это производные углеводородов, в молекулах которых один или нескольких атомов водорода замещены гидроксильными группами
- 4. НАХОЖДЕНИЕ В ПРИРОДЕ Спирты имеют самое широкое распространение в природе, особенно в виде сложных эфиров, однако
- 5. В эфирных маслах зеленых частей многих растений содержится «спирт листьев», придающий им характерный запах. Фенилэтиловый спирт
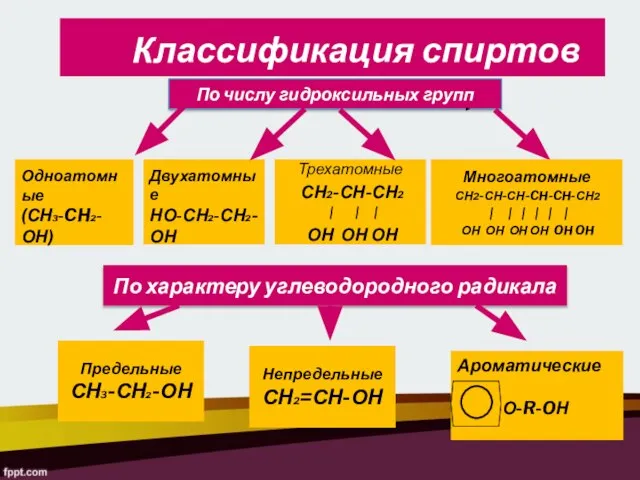
- 6. По числу гидроксильных групп Одноатомные (СН3-CH2-ОН) Двухатомные НО-СН2-СН2-ОН Трехатомные СН2-СН-СН2 | | | ОН ОН ОН
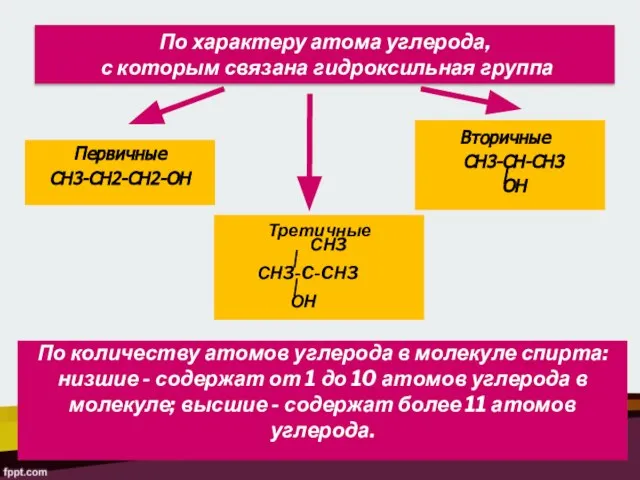
- 7. По характеру атома углерода, с которым связана гидроксильная группа Первичные СН3-СН2-СН2-ОН Вторичные СН3-СН-СН3 | ОН Третичные
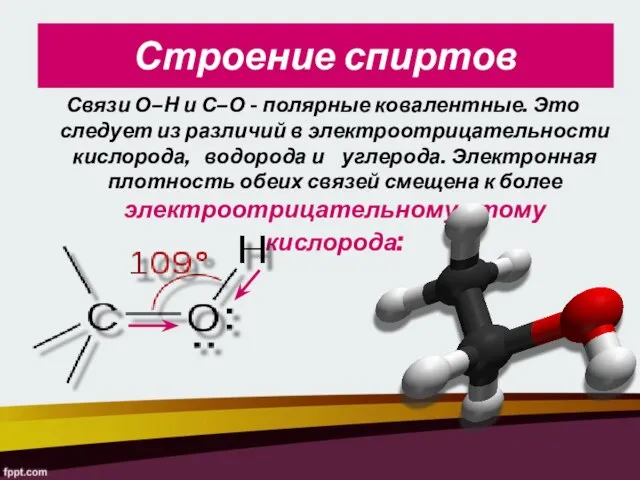
- 8. Строение спиртов Связи О–Н и С–О - полярные ковалентные. Это следует из различий в электроотрицательности кислорода,
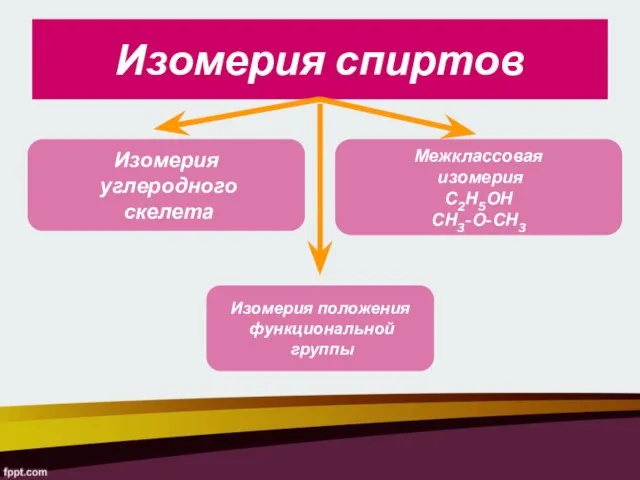
- 9. Изомерия спиртов
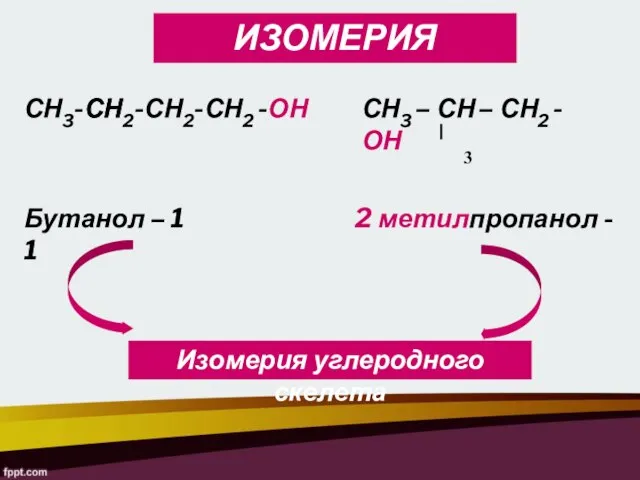
- 10. ИЗОМЕРИЯ СН3-СН2-СН2-СН2 -ОН СН3 – СН – СН2 -ОН Бутанол – 1 2 метилпропанол - 1
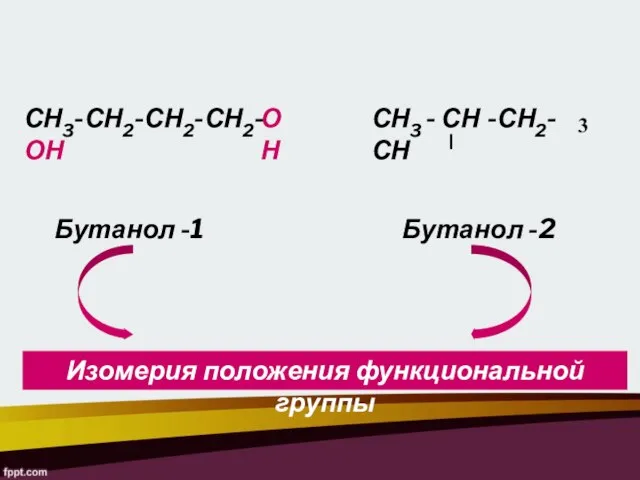
- 11. СН3-СН2-СН2-СН2- ОН СН3 - СН -СН2- СН 3 ОН Бутанол -1 Бутанол -2 Изомерия положения функциональной
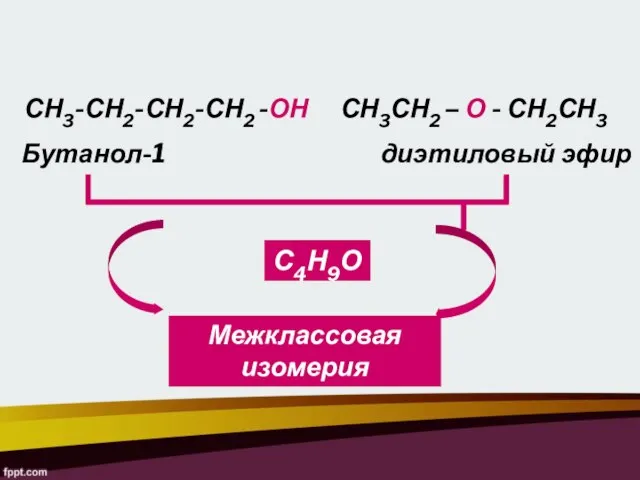
- 12. СН3СН2 – О - СН2СН3 Бутанол-1 диэтиловый эфир СН3-СН2-СН2-СН2 -ОН С4Н9О Межклассовая изомерия
- 13. Физические свойства Низшие спирты (до C15) — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются
- 14. Водородная связь между атомами водорода одной молекулы и атомом сильно электроотрицательных элементов (кислорода, фтора) другой молекулы.
- 15. Благодаря полярности гидроксильной группы и наличию в ней электродефицитного атома водорода, между молекулами спирта возникают водородные
- 16. Получение 1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при
- 17. 2. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей: R—Br +
- 18. Получение 3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные:
- 19. 4. Действие реактивов Гриньяра на карбонильные соединения . 5. Этанол получают при спиртовом брожении глюкозы С6Н12О6
- 20. ХИМИЧЕСКИЕ СВОЙСТВА Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы ОН-. Связи С-О и
- 21. проявляются слабые кислотные свойства спиртов Скорость реакций, при которых разрывается связь О-Н, уменьшается в ряду: первичные
- 22. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами: 2С2Н5-ОН + 2K→
- 23. 2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает
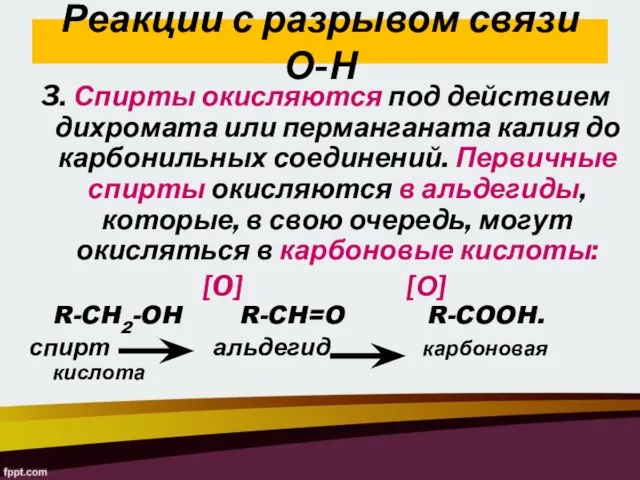
- 24. Реакции с разрывом связи О-Н 3. Спирты окисляются под действием дихромата или перманганата калия до карбонильных
- 25. Реакции с разрывом связи С-О. Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном
- 26. Спирты обратимо реагируют с галогеноводородными кислотами (здесь проявляются слабые основные свойства спиртов): ROH + HCl RCl
- 27. Применение спиртов самостоятельно найти материал из разных источников
- 29. Скачать презентацию

















 Структурні дослідження електрохімічних інтерфейсів методами малокутового розсіяння нейтронів та нейтронної рефлектометрії
Структурні дослідження електрохімічних інтерфейсів методами малокутового розсіяння нейтронів та нейтронної рефлектометрії Пищевые добавки в продуктах питания
Пищевые добавки в продуктах питания Фізико–хімічні властивості плюмбум телуриду та дефектна підсистема твердих розчинів PbTe-Sb2Te3
Фізико–хімічні властивості плюмбум телуриду та дефектна підсистема твердих розчинів PbTe-Sb2Te3 ПУТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ
ПУТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ Презентация по дисциплине «Химия» по теме «Электролиз (на примере электролиза расплава хлорида натрия и раствора хлорида меди (I
Презентация по дисциплине «Химия» по теме «Электролиз (на примере электролиза расплава хлорида натрия и раствора хлорида меди (I Загадки химии. Занятие 2
Загадки химии. Занятие 2 Современная нефтехимия
Современная нефтехимия Качественный анализ (часть 1)
Качественный анализ (часть 1) Косметичні засоби Виконала учениця 9 класу Максименко Анастасія
Косметичні засоби Виконала учениця 9 класу Максименко Анастасія  Решение задач с использованием массовой доли выхода продукта.
Решение задач с использованием массовой доли выхода продукта. Валентность и степень окисления
Валентность и степень окисления Electron Structure
Electron Structure Мыс айналымы
Мыс айналымы Основные понятия и законы химии
Основные понятия и законы химии Эпоксидные смолы
Эпоксидные смолы Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин) Группа веществ, изолируемых из биологического объекта путём минерализации («Металлические» яды)
Группа веществ, изолируемых из биологического объекта путём минерализации («Металлические» яды) Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс Введение в химию. 8 класс
Введение в химию. 8 класс Органические вещества. Предмет органической химии
Органические вещества. Предмет органической химии Кальций (Са)
Кальций (Са) Изомерия и ее виды
Изомерия и ее виды Силікон Корєшкова А. В. 11-М
Силікон Корєшкова А. В. 11-М  Способы разделения смесей
Способы разделения смесей Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Поливинилацетат
Поливинилацетат Химия в медицине
Химия в медицине Инструктаж Правила поведения на каникулах
Инструктаж Правила поведения на каникулах