Содержание
- 2. Степень окисления - условный заряд атома в молекуле, исходя из предположения, что все связи между атомами
- 3. NB!!!!!!! 3. Постоянную степень окисления имеют в соединениях атомы: l группы (+1) – Li, Na, K,
- 4. NB!!!!!!! Помним, что: Атомы металлов во всех сложных веществах имеют только положительные степени окисления Атомы неметаллов
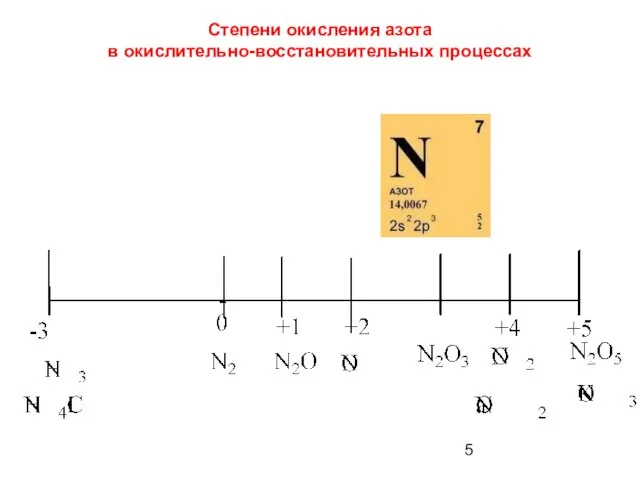
- 5. Степени окисления азота в окислительно-восстановительных процессах
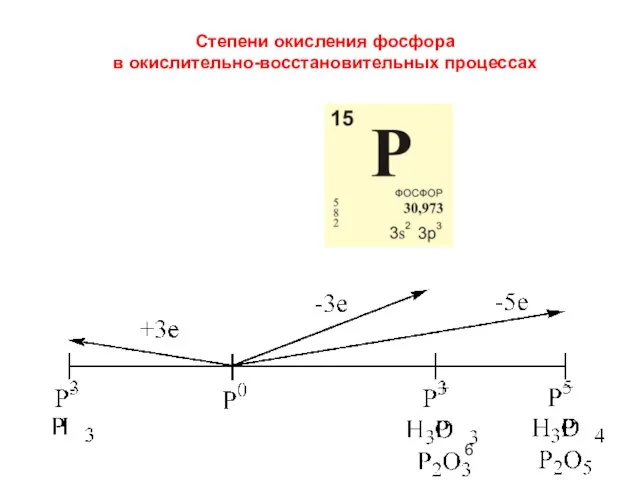
- 6. Степени окисления фосфора в окислительно-восстановительных процессах
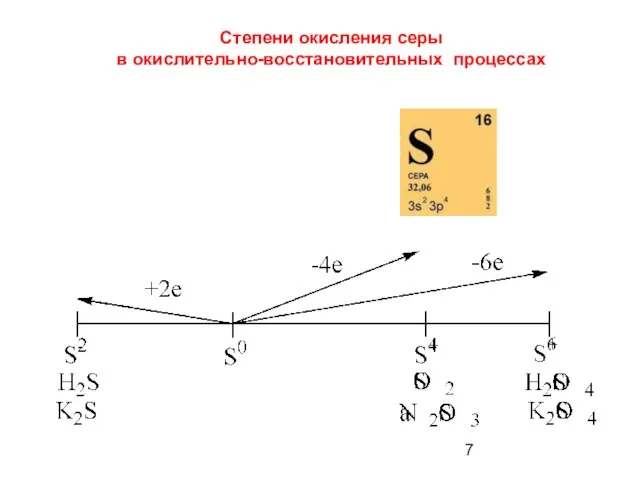
- 7. Степени окисления серы в окислительно-восстановительных процессах
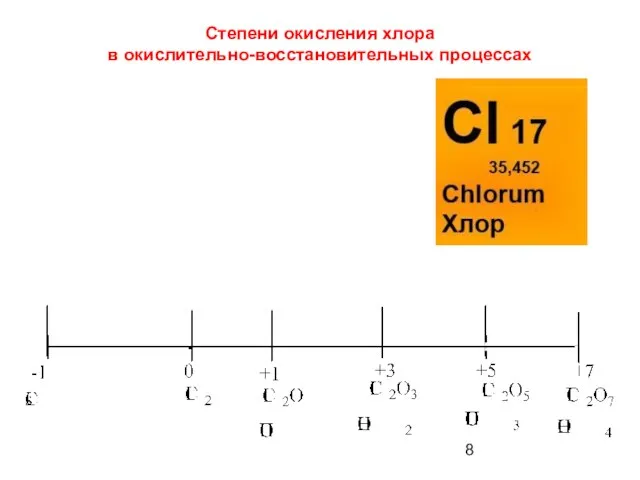
- 8. Степени окисления хлора в окислительно-восстановительных процессах
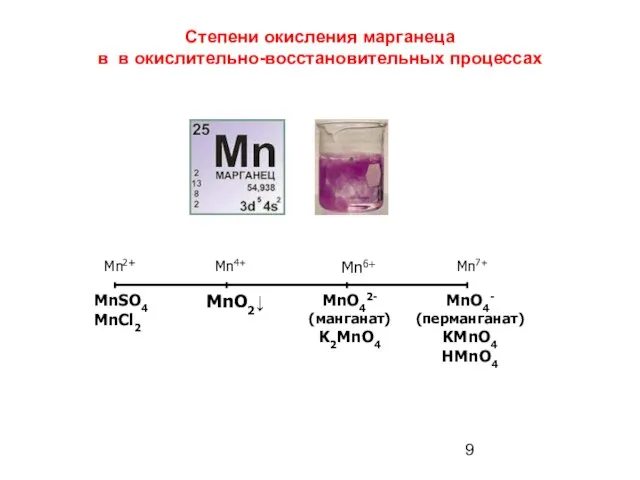
- 9. Степени окисления марганеца в в окислительно-восстановительных процессах
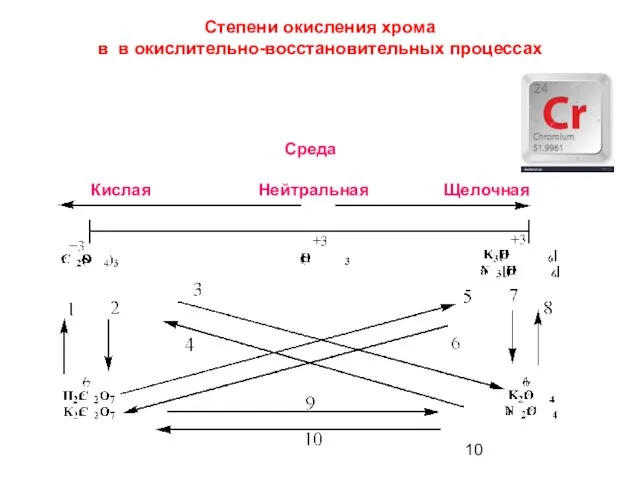
- 10. Среда Кислая Нейтральная Щелочная Степени окисления хрома в в окислительно-восстановительных процессах
- 11. Примеры окислительно-восстановительных процессов Sb + CI2 → SbCI3 2HgO → 2 Hg + O2
- 12. 2C4H10 + 13O2 → 8CO2 + 10H2O 2K +2H2O → 2KOH + H2↑ 4Fe + 3O2
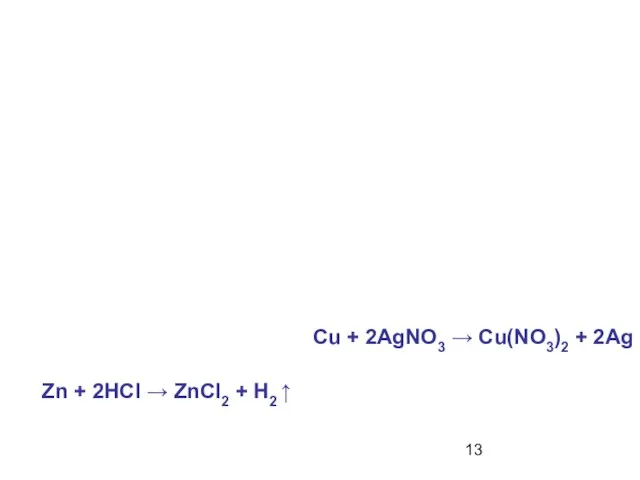
- 13. Zn + 2HCI → ZnCI2 + H2 ↑ Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
- 14. Тест №9 Степень окисления
- 15. 1. Укажите степень окисления атома марганца в составе иона МnО4-: 1) +2 2) +4 3) +6
- 16. 2. В составе какого иона степень окисления атома фосфора равна +1? 1) Н2РО2- 2) НРО32- 3)
- 17. 3. Укажите ряд, в котором формулы соединений и ионов записаны в порядке увеличения степени окисления атомов
- 18. 4. Степень окисления атома водорода равна -1 в составе соединений, формулы которых: 1) NaBH4 и SiH4
- 19. 5. Степень окисления атома азота в составе гидразина N2H4 и гидроксиламина NH2OH соответственно равна: 1) -2
- 20. 6. Такую же степень окисления, как и в ионе аммония, атом азота имеет в составе двух
- 21. 7. Степень окисления атома металла последовательно возрастает в ряду ионов: 1) FeS2, СrO42-, МnO4- 2) К2S2,
- 22. 8. Степень окисления атома углерода в составе СН4 такая же, как и атома кремния в соединении,
- 23. 9. Свои соответственно максимальную и минимальную степени окисления атом хлора проявляет в составе частиц: 1) ClF
- 24. 10. Даны формулы соединений кремния: K2Si2О5 SiH4 Mg2Si SiF4 Число соединений, в которых степень окисления атома
- 25. Ответы (тест№9)
- 26. 1. Установите соответствие между формулой соединения и значением степени окисления хлора в нём Часть В
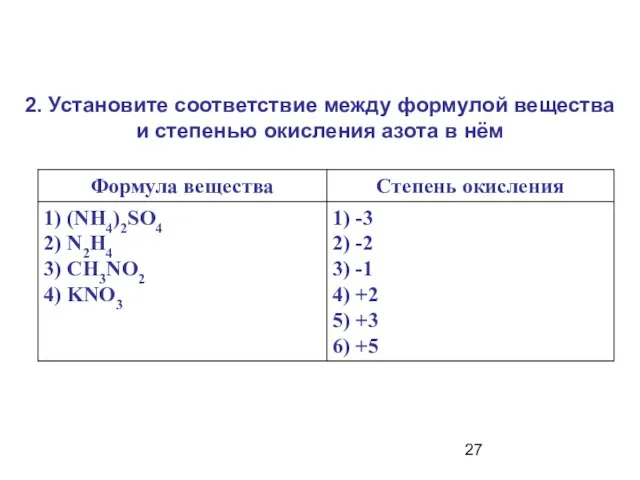
- 27. 2. Установите соответствие между формулой вещества и степенью окисления азота в нём
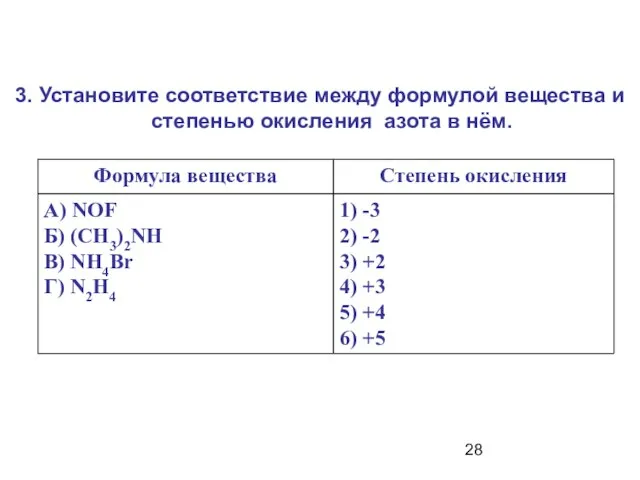
- 28. 3. Установите соответствие между формулой вещества и степенью окисления азота в нём.
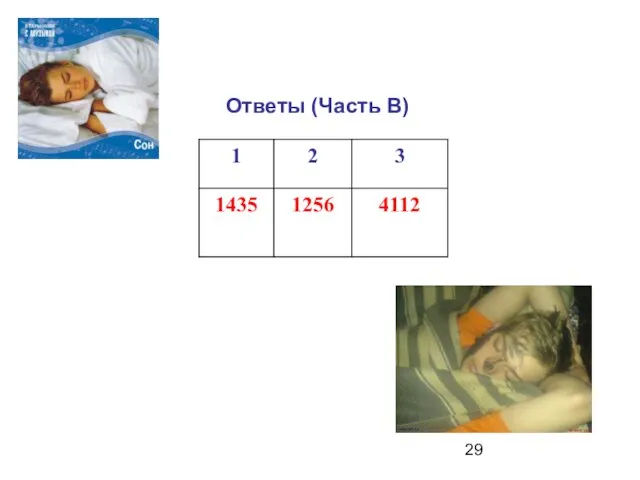
- 29. Ответы (Часть В)
- 30. Ряд напряжений металлов Li K Ca Na Mg Ве AI Mn Zn Cr Fe Co Ni
- 31. а) H2SO4 + металл Fe, Cr, Al реагируют с H2SO4 (к) только при нагревании с выделением
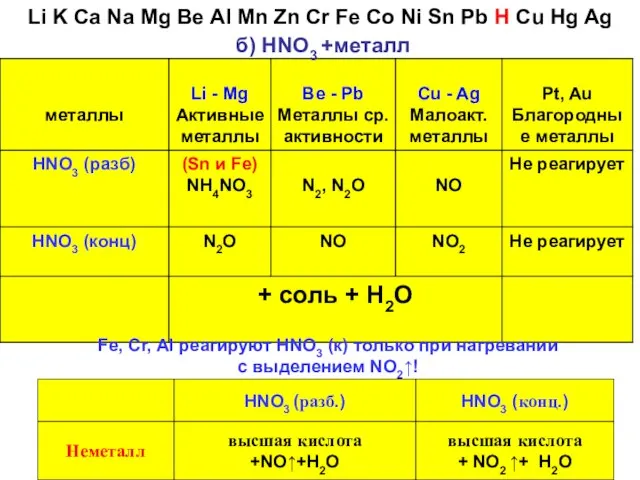
- 32. б) HNO3 +металл Fe, Cr, Al реагируют HNO3 (к) только при нагревании с выделением NO2↑! Li
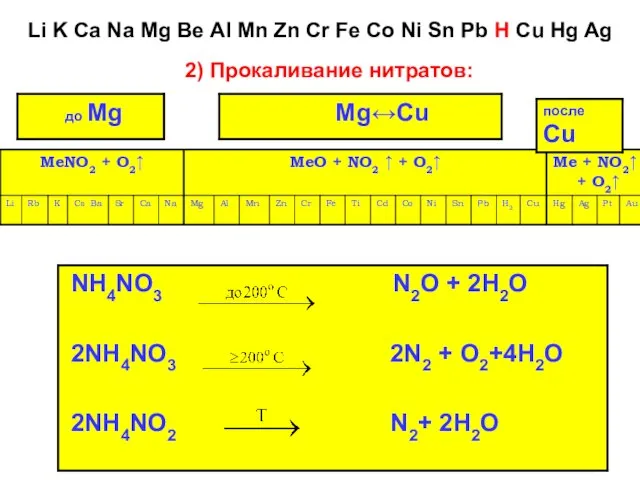
- 33. 2) Прокаливание нитратов: Li K Ca Na Mg Ве AI Mn Zn Cr Fe Co Ni
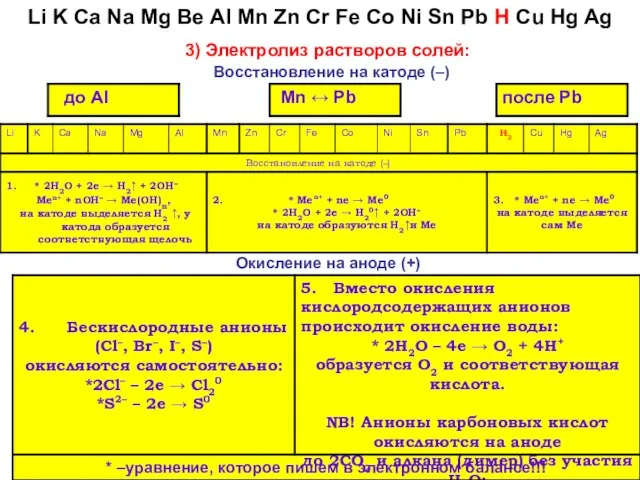
- 34. Окисление на аноде (+) 3) Электролиз растворов солей: Восстановление на катоде (–) Li K Ca Na
- 35. 4) Более активные металлы вытесняют менее активные из растворов солей: (При этом степень окисления металла в
- 36. 5) Чем больше разность активностей металлов, тем первоочередней идет реакция: 1. Zn + 2AgNO3 → Zn(NO3)2
- 38. Скачать презентацию




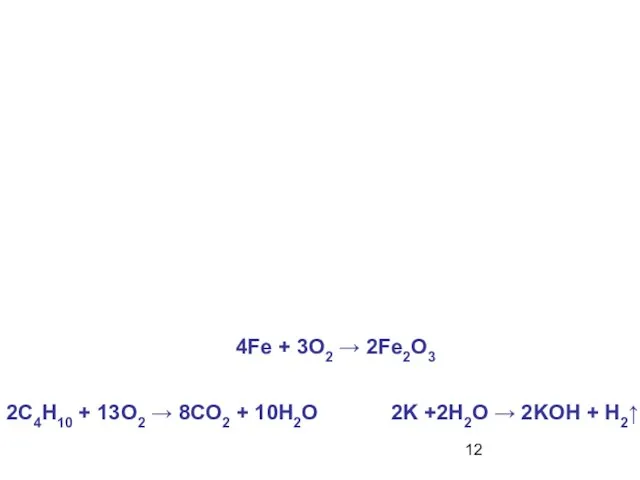
















 Презентация по Химии "Нафта і нафтопродукти" - скачать смотреть бесплатно
Презентация по Химии "Нафта і нафтопродукти" - скачать смотреть бесплатно Деградация пищевых и клеточных белков. (Лекция 1)
Деградация пищевых и клеточных белков. (Лекция 1) Химические добавки к бетонам
Химические добавки к бетонам Изготовление духов в домашних условиях
Изготовление духов в домашних условиях Автор: Васильева Е.Д. Учитель физики МОУ гимназия г.Советский
Автор: Васильева Е.Д. Учитель физики МОУ гимназия г.Советский Алюминий и его соединения
Алюминий и его соединения Кислород, его общая характеристика и свойства
Кислород, его общая характеристика и свойства Алюминий и его органические производные
Алюминий и его органические производные Химическая связь
Химическая связь Кислоты и классы химических веществ. 8 класс
Кислоты и классы химических веществ. 8 класс Презентация по Химии "История развития химии" - скачать смотреть бесплатно
Презентация по Химии "История развития химии" - скачать смотреть бесплатно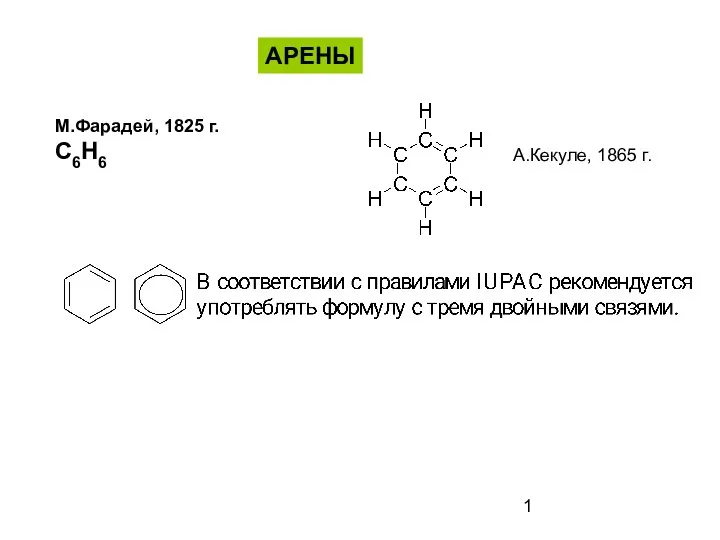 Ароматические соединения - арены
Ароматические соединения - арены Комплексные соединения
Комплексные соединения Основы почвоведения, растительный грунт. Изменение физических и химических свойств почв для повышения жизнеспособности растений
Основы почвоведения, растительный грунт. Изменение физических и химических свойств почв для повышения жизнеспособности растений Синтез наноматериалов золь-гель методом. (Лекция 5)
Синтез наноматериалов золь-гель методом. (Лекция 5) Гранулирование. Виды грануляции
Гранулирование. Виды грануляции Основные понятия и законы химии
Основные понятия и законы химии Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности
Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности Brass
Brass Химия элементов IVA группы
Химия элементов IVA группы Диаграмма состояния системы железо – углерод
Диаграмма состояния системы железо – углерод Олигосахариды
Олигосахариды  Конкурс интерактивных презентаций «Интерактивная мозаика» Pedsovet.su
Конкурс интерактивных презентаций «Интерактивная мозаика» Pedsovet.su  Биологическое окисление
Биологическое окисление Связь ЭДС с составом фаз. Вывод из межфазных равновесий
Связь ЭДС с составом фаз. Вывод из межфазных равновесий Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Хемосинтез. Автотрофное питание
Хемосинтез. Автотрофное питание Производство HNO3
Производство HNO3