Содержание
- 2. КВАНТОВАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА В основе лежат положения: 1. Электрон имеет двойственную (корпускулярно-волновую) природу, т.е. может
- 3. Длина волны электрона определяется соотношением Де Бройля: λ = h / (m υ) λ – длина
- 4. 2. Для электрона невозможно одновременно точно измерить координату и скорость. 3. Электрон в атоме не движется
- 5. 4. Ядра атомов состоят из протонов и нейтронов (нуклоны). Заряд протона равен по величине и противоположен
- 6. Различные виды атомов имеют общее название – нуклиды. Их можно характеризовать любыми двумя числами из трех
- 7. Связь между ними: Z = A – N N = A – Z A = Z
- 8. Появление гипотезы де Бройля открыло принципиальную возможность описывать электрон в атоме уже не как частицу, а
- 9. где: ð2- дифференциальный оператор, представляющий собой сумму вторых частных производных по соответствующим координатам, m - масса
- 10. Решение уравнения Шредингера приводит к необходимости ввести постоянные величины, называемые квантовыми числами.
- 11. n – главное квантовое число; l - орбитальное квантовое число; m – магнитное квантовое число; s
- 12. ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО Характеризует общий запас энергии и возможные энергетические состояния электрона в атоме. Принимает целые
- 13. Электроны внешнего энергетического уровня обладают максимальным запасом энергии и наименьшей связью с ядром. Максимальное число электронов,
- 14. Орбитальное квантовое число - l Электроны одного и того же уровня могут различаться значениями энергии, образуя
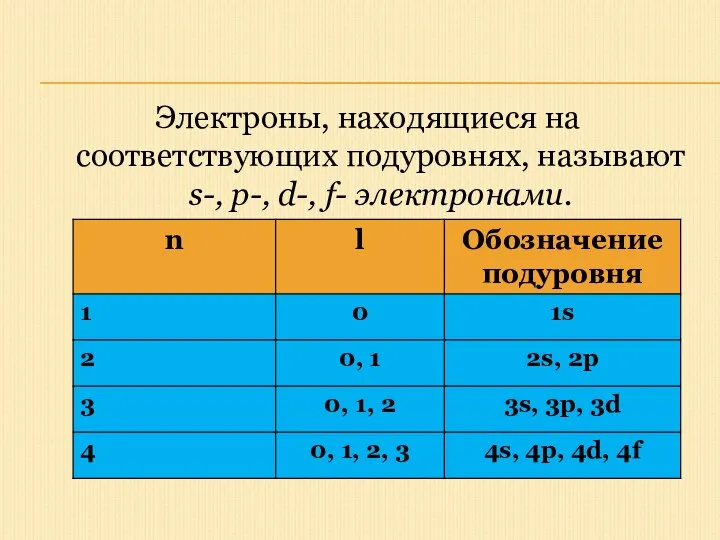
- 15. Электроны, находящиеся на соответствующих подуровнях, называют s-, p-, d-, f- электронами.
- 16. Таким образом, энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и
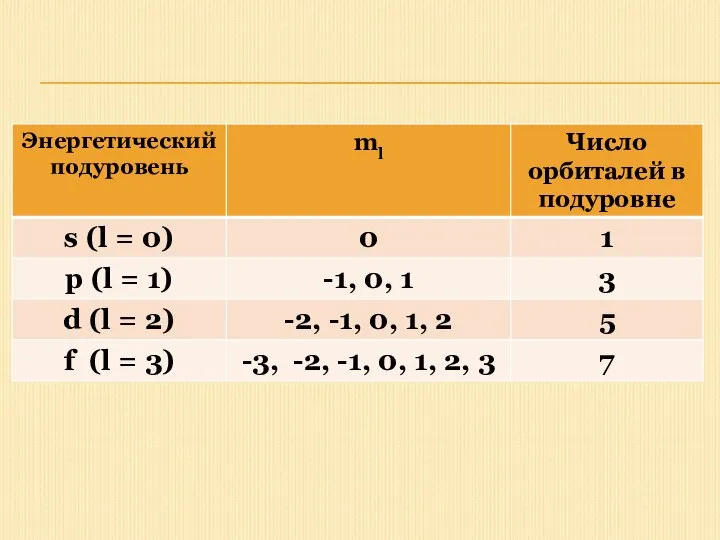
- 17. Магнитное квантовое число - m Положение (ориентация) электронного облака в пространстве определяется значением магнитного квантового числа.
- 19. СПИНОВОЕ КВАНТОВОЕ ЧИСЛО - s Спиновое квантовое число может принимать, следовательно, только два значения и в
- 20. ЗАПОЛНЕНИЕ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ Распределение электронов в атомах элементов определяется тремя основными положениями: принципом Паули, принципом
- 21. Принцип Паули → В атоме не может быть электронов с одинаковым набором всех четырех квантовых чисел.
- 22. Правило Хунда → на каждом подуровне сумма спинов электронов должна быть максимальной по абсолютному значению (модулю).
- 23. Принцип наименьшей энергии Электрон всегда занимает орбиталь с наименьшей энергией. Последовательность заполнения атомных электронных орбиталей в
- 24. Первое правило Клечковского: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с
- 25. Второе правило Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел (n+l) заполняется подуровень с
- 27. Скачать презентацию






















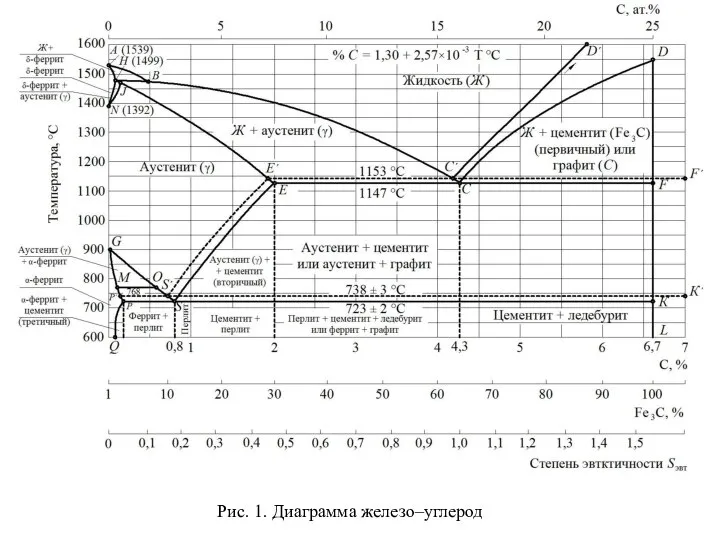 Чугуны и стали
Чугуны и стали Круговорот азота в природе
Круговорот азота в природе Презентация по Химии "Проблема вмісту нітратів в продуктах харчування" - скачать смотреть бесплатно
Презентация по Химии "Проблема вмісту нітратів в продуктах харчування" - скачать смотреть бесплатно Непредельные углеводороды ряда этилена = алкены
Непредельные углеводороды ряда этилена = алкены Фармакодинамика лекарственных средств
Фармакодинамика лекарственных средств Материаловедение. Основы металловедения
Материаловедение. Основы металловедения Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж
Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж Применение центрифугирования
Применение центрифугирования Структурная механика композитов. Композитный монослой
Структурная механика композитов. Композитный монослой Теория электролитической диссоциации
Теория электролитической диссоциации Презентация по Химии "Презентация Пищевые цепи" - скачать смотреть
Презентация по Химии "Презентация Пищевые цепи" - скачать смотреть  1oe_zanyatie (1)
1oe_zanyatie (1) МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор
МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно
Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно Синтез высокомолекулярных соединений
Синтез высокомолекулярных соединений Жидкие кристаллы
Жидкие кристаллы Подготовка к ГИА. А5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений
Подготовка к ГИА. А5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений Аміни. Метиламін
Аміни. Метиламін Презентация для класса Способы получения натрия
Презентация для класса Способы получения натрия  Полиэтилен высокого давления
Полиэтилен высокого давления Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф
Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф Коллоидные ПАВ. Солюбилизация
Коллоидные ПАВ. Солюбилизация Залежність фізичних властивостей речовин від типу кристалічних ґраток
Залежність фізичних властивостей речовин від типу кристалічних ґраток Химическая связь
Химическая связь Дисперсные системы
Дисперсные системы Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья
Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья  Вугілля і продукти його переробки.Вуглеводнева сировина й охорона довкілля.
Вугілля і продукти його переробки.Вуглеводнева сировина й охорона довкілля.  Минералы и их свойства
Минералы и их свойства