Содержание
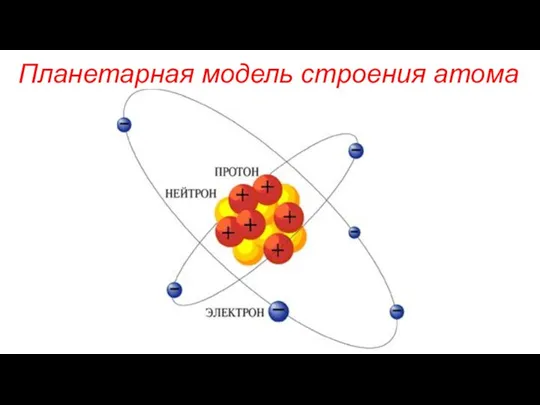
- 2. Планетарная модель строения атома
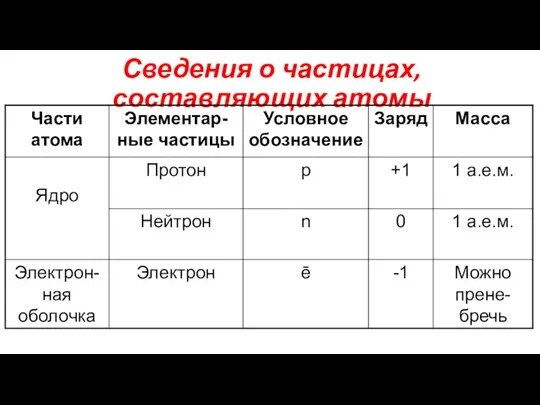
- 3. Сведения о частицах, составляющих атомы
- 4. Порядковый номер элемента: Заряд ядра атома (Z) Количество протонов в ядре Количество электронов
- 6. Электронная оболочка атома – совокупность всех электронов в атоме (число электронов в атоме равно числу протонов,
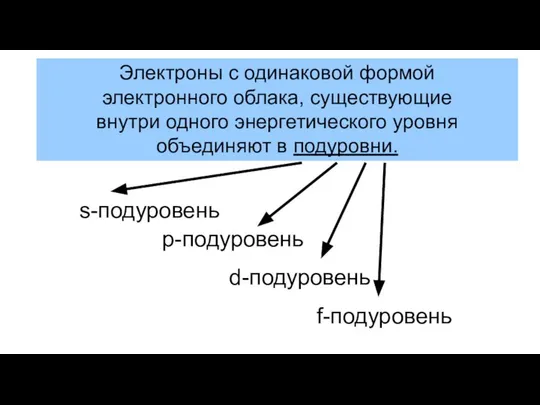
- 7. Электроны с одинаковой формой электронного облака, существующие внутри одного энергетического уровня объединяют в подуровни.
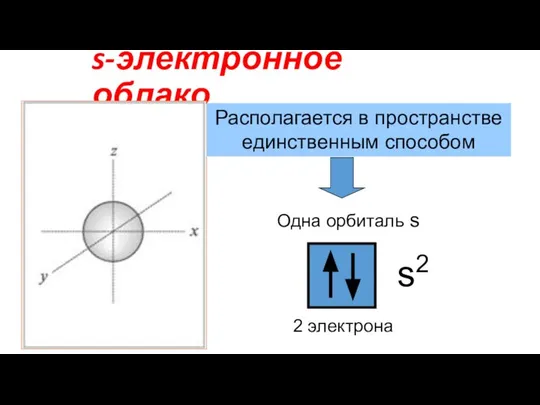
- 8. s-электронное облако Располагается в пространстве единственным способом 2 электрона s2
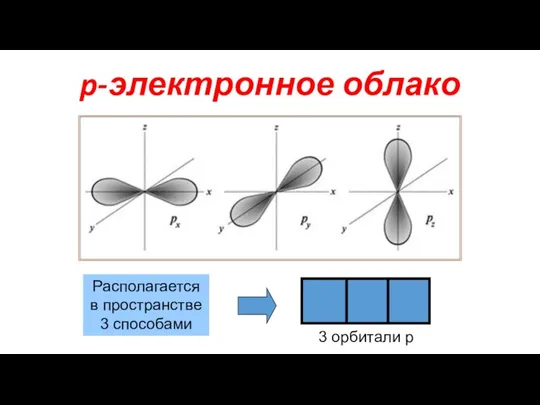
- 9. p-электронное облако Располагается в пространстве 3 способами
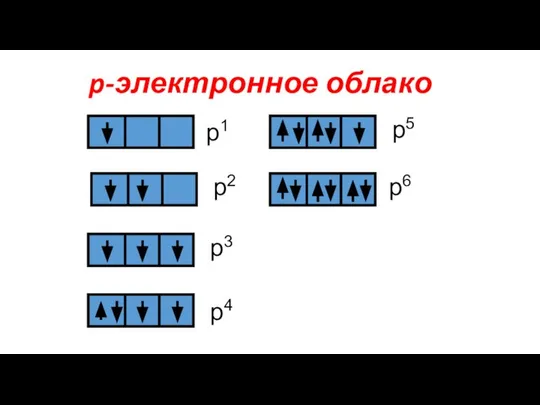
- 10. p-электронное облако р1 р2 р3 р4 р5 р6
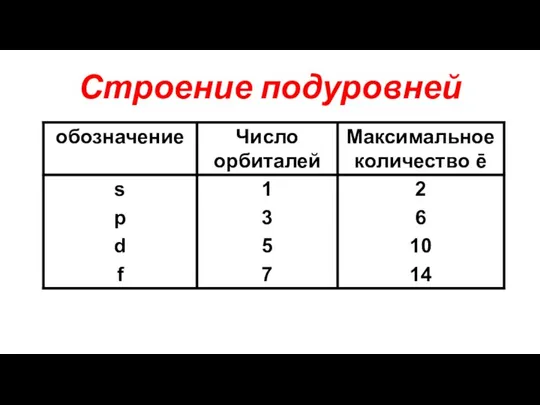
- 11. Строение подуровней
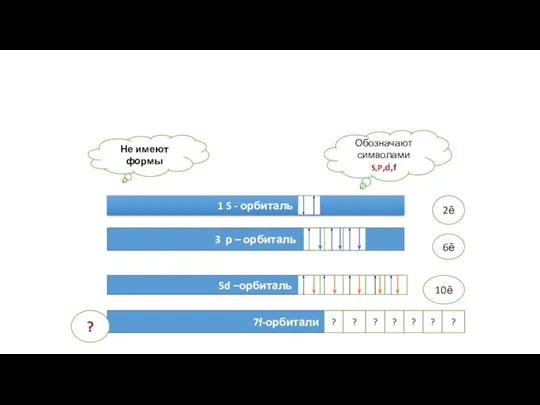
- 12. Формы электронных орбиталей S- облака (сферической формы) Р – облака (гантелеобразной формы) d – облака f
- 13. Форма и размеры того или иного электронного облака определяются атомными орбиталями Принцип Паули Не имеют формы
- 14. Порядок заполнения электронами орбиталей атома определяется тремя законами природ: 1. Принцип наименьшей энергии - электроны заполняют
- 15. Схемы строения атомов Заряд ядра = № элемента Количество энергетических уровней (электронных слоев) = № периода
- 17. Скачать презентацию






 Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2
Термическая переработка газов, нефтяных фракций и остатков нефтепереработки. Лекция 2 Электрофоретические и хроматографические методы
Электрофоретические и хроматографические методы Качественный анализ и его методы
Качественный анализ и его методы Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот Ліпіди. Класифікація ліпідів
Ліпіди. Класифікація ліпідів Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Адсорбция. Адсорбциондық тепе-теңдік
Адсорбция. Адсорбциондық тепе-теңдік Круговорот азота
Круговорот азота Карбонаты и фосфаты
Карбонаты и фосфаты Гликолиз. Глюконеогенез. Пентозофосфатный путь
Гликолиз. Глюконеогенез. Пентозофосфатный путь Нефть. Образование нефти
Нефть. Образование нефти Строение атома
Строение атома Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул
Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул Тұндыру әдістері
Тұндыру әдістері Презентация по Химии "Формы Выделения минералов" - скачать смотреть
Презентация по Химии "Формы Выделения минералов" - скачать смотреть  Материалы космической техники
Материалы космической техники Нахождение массовой доли
Нахождение массовой доли Ґрунт Основні забруднювачі земельної площі: шлаки, синтетичні полімери, побутові відходи, кар'єри. Проблеми літосфери: за
Ґрунт Основні забруднювачі земельної площі: шлаки, синтетичні полімери, побутові відходи, кар'єри. Проблеми літосфери: за Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Интересные свойства редких металлов
Интересные свойства редких металлов Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Методы экстрагирования ЛРС и оборудование
Методы экстрагирования ЛРС и оборудование Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды При растворении в воде гидроксид-ионы образует вещество, формула которого При растворении в воде гидроксид-ионы образует веществ
При растворении в воде гидроксид-ионы образует вещество, формула которого При растворении в воде гидроксид-ионы образует веществ Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Вещества и их свойства
Вещества и их свойства Общие методические приемы в оценке качества лекарственных форм
Общие методические приемы в оценке качества лекарственных форм Неравновесные электрохимические методы. Вольтамперометрия
Неравновесные электрохимические методы. Вольтамперометрия