Содержание
- 2. Метод электронно-ионного баланса Окислительно-восстановительные реакции бывает сложно уровнять. K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 +
- 3. Один пример 1. Сначала записываем схему реакции: S + HNO3 = H2SO4 + NO
- 4. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. S + HNO3 = H2SO4
- 5. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 6. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 7. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 8. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 9. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 10. Метод электронно-ионного баланса Попробуем: HCl + Cu + O2 ? CuCl2 + H2O
- 11. Окислители можно разделить на группы По проявлению окислительных свойств Окислители – акцепторы электронов Группа 1 Температура
- 12. Группа 1: Окислители, проявляющие окислительные свойства при повышенной или очень высокой температуре. Cl2, F2, KClO3, K2FeO4,
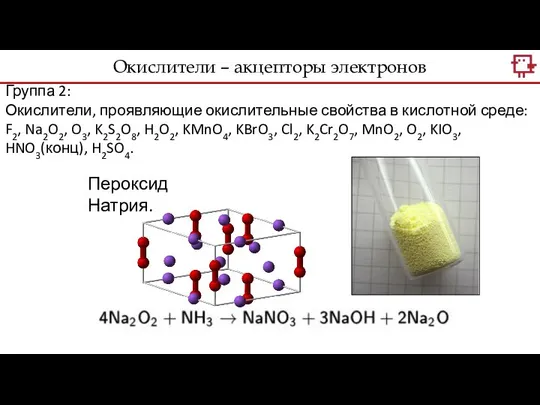
- 13. Группа 2: Окислители, проявляющие окислительные свойства в кислотной среде: F2, Na2O2, O3, K2S2O8, H2O2, KMnO4, KBrO3,
- 14. Группа 3: Окислители, проявляющие окислительные свойства в щелочной среде: F2, K2S2O8, Сl2O4, Na2O2, Br2, H2O2, KMnO4,
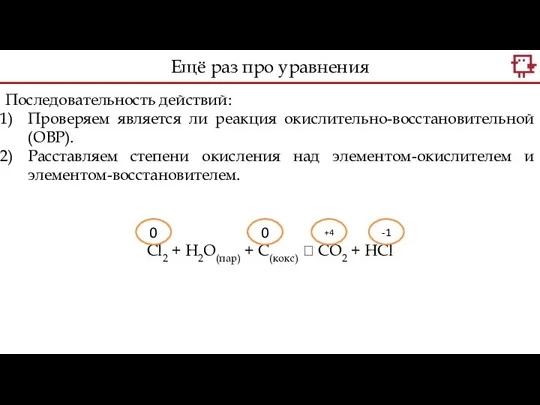
- 15. Последовательность действий: Проверяем является ли реакция окислительно-восстановительной (ОВР). Чем ОВР отличается от других реакций? Cl2 +
- 16. Последовательность действий: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и элементом-восстановителем. Cl2
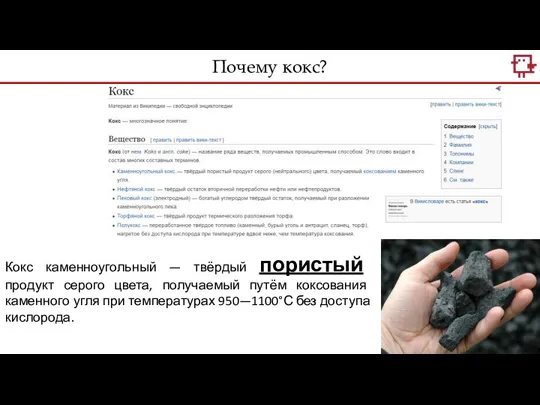
- 17. Кокс каменноугольный — твёрдый пористый продукт серого цвета, получаемый путём коксования каменного угля при температурах 950—1100°С
- 18. Последовательность действий: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и элементом-восстановителем. Cl2
- 19. Последовательность действий : Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и элементом-восстановителем.
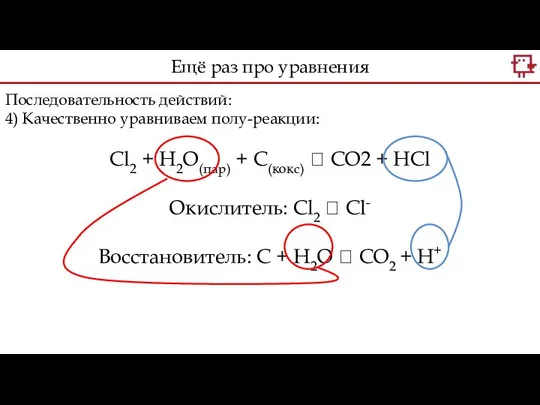
- 20. Последовательность действий: 4) Качественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ? CO2 + HCl Окислитель:
- 21. Последовательность действий: 4) Качественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ? CO2 + HCl Окислитель:
- 22. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ?
- 23. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ?
- 24. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и уравниваем их
- 25. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и уравниваем их
- 26. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и уравниваем их
- 27. Последовательность действий: 8) Складываем полу-реакции с учётом коэффициентов: Сl2 ? 2Cl- С + 2H2O ? CO2
- 28. Последовательность действий: 8) Складываем полу-реакции с учётом коэффициентов: Сl2 ? 2Cl- С + 2H2O ? CO2
- 29. SO2 + SeO2 + H2O ? Se + H2SO4 УРАВНЯТЬ!!!
- 31. Скачать презентацию
























 Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Майлардың анықтамасы
Майлардың анықтамасы Общая радиохимия. Свойства радиоколлоидов
Общая радиохимия. Свойства радиоколлоидов Строение атома углерода
Строение атома углерода Да здравствует мыло душистое
Да здравствует мыло душистое Химические и физико-химические методы анализа. Сущность и методы качественного анализа
Химические и физико-химические методы анализа. Сущность и методы качественного анализа Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Уравнения химических реакций
Уравнения химических реакций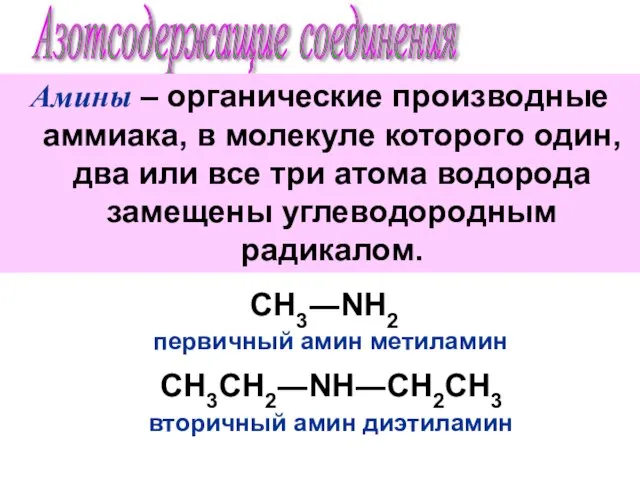 Азотсодержащие соединения. Амины
Азотсодержащие соединения. Амины Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Гидролиз. Сущность процесса гидролиза
Гидролиз. Сущность процесса гидролиза Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Исследовательский проект «Кристаллы»
Исследовательский проект «Кристаллы» Минералы. Классы минералов
Минералы. Классы минералов Спирты
Спирты Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Пищевые добавки
Пищевые добавки Основания и кислоты. Тема 2
Основания и кислоты. Тема 2 Зміна ліпідів за технологічної обробки
Зміна ліпідів за технологічної обробки Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_
Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_ Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть  Области применения спиртов
Области применения спиртов Применение синтетических полимеров в вооружении
Применение синтетических полимеров в вооружении Пластик, пластмасса
Пластик, пластмасса Распознавание химических соединений
Распознавание химических соединений Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Сера и ее аллотропные модификации. (9 класс)
Сера и ее аллотропные модификации. (9 класс) Виды химической связи
Виды химической связи