Содержание
- 2. Скорость химических реакций Химическая кинетика изучает скорость и механизмы химических реакций
- 3. Гомогенные и гетерогенные системы Гетерогенные системы Фаза – совокупность всех гомогенных частей системы, одинаковых по составу
- 4. Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах
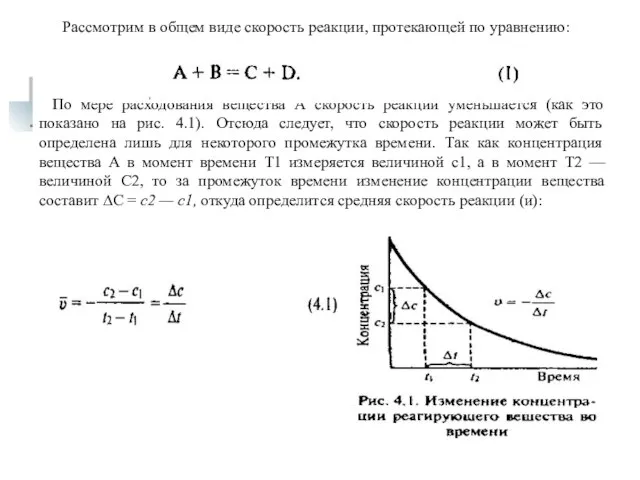
- 5. По мере расходования вещества А скорость реакции уменьшается (как это показано на рис. 4.1). Отсюда следует,
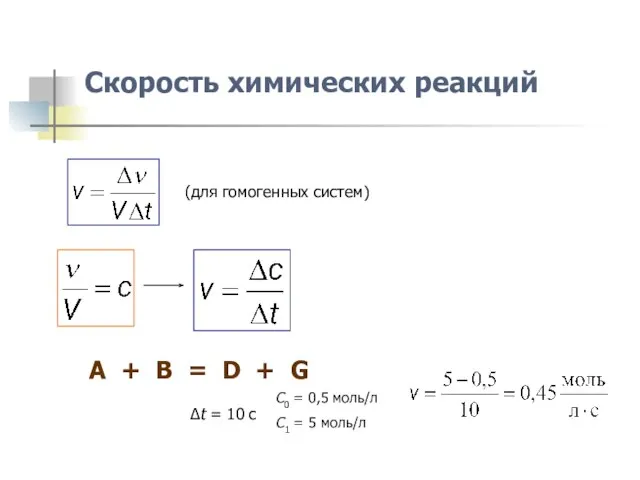
- 6. Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 0,5
- 7. Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 2
- 8. Факторы, от которых зависит скорость реакции Природа реагирующих веществ Концентрация веществ в системе Площадь поверхности (для
- 9. 1. Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы)
- 10. 2.Влияние температуры Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза
- 11. Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации
- 12. На примере реакции в общем виде: А2+ В2 = 2АВ. Ось ординат характеризует потенциальную энергию системы,
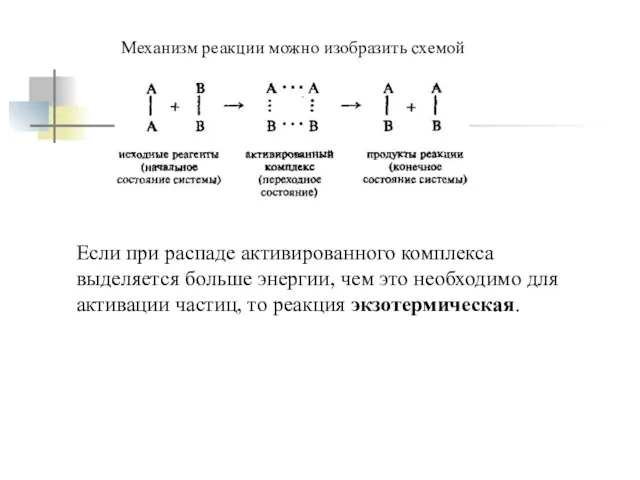
- 13. Механизм реакции можно изобразить схемой Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо
- 14. Как видно из рис. 4.2, разность энергий конечного состояния системы и начального равна тепловому эффекту реакции.
- 15. Катализ Йенс Якоб Берцелиус ввел термин «катализ» в 1835 г. Катализатор – вещество, изменяющее скорость реакции,
- 16. Механизм разложения пероксида водорода 2H2O2 = 2H2O + O2 (1) H2O2 = H+ + HO2- (2)
- 17. Разложение H2O2 в присутствии Fe3+ H2O2 = H+ + HO2- HO2- + Fe3+ = Fe2+ +
- 19. Скачать презентацию













 Iron Oxide
Iron Oxide Зміна ліпідів за технологічної обробки
Зміна ліпідів за технологічної обробки Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Гидрокаталитические процессы
Гидрокаталитические процессы Физические свойства фтороводорода
Физические свойства фтороводорода Аммиак
Аммиак Химия элементов 16 (VIA) группы
Химия элементов 16 (VIA) группы Растворы. Общая характеристика растворов
Растворы. Общая характеристика растворов Природний газ
Природний газ  Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз
Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз Топливо и его свойства
Топливо и его свойства Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону
Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть
Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть  Презентация по Химии "Массовая доля вещества в растворе" - скачать смотреть
Презентация по Химии "Массовая доля вещества в растворе" - скачать смотреть  Основные пути внутриклеточного метаболизма углеводов
Основные пути внутриклеточного метаболизма углеводов Вода. Химические и физические свойства
Вода. Химические и физические свойства Исследование шоколада на содержание посторонних примесей. Выполнила: Астраханцева Виктория ученица 11 «Б» класса Лицея №95 Научн
Исследование шоколада на содержание посторонних примесей. Выполнила: Астраханцева Виктория ученица 11 «Б» класса Лицея №95 Научн Основы органической химии
Основы органической химии Презентация по Химии "«Кристаллические решетки»" - скачать смотреть
Презентация по Химии "«Кристаллические решетки»" - скачать смотреть  Основные сведения о композитах. Понятие о композитах
Основные сведения о композитах. Понятие о композитах Cоляная кислота и ее соли
Cоляная кислота и ее соли Личный опыт сортировки мусора
Личный опыт сортировки мусора Характеристика кислоты
Характеристика кислоты Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Энергетика химических процессов
Энергетика химических процессов Методичне об'єднання учителів біології та хімії Христинівської спеціалізованої школи І – ІІІ ступенів ім. О.Є.Корнійчука
Методичне об'єднання учителів біології та хімії Христинівської спеціалізованої школи І – ІІІ ступенів ім. О.Є.Корнійчука Викторина по химии
Викторина по химии