Содержание
- 2. Общая характеристика воды Вода является самым распространенным веществом на Земле; Жизнь зародилась в воде, и вода
- 3. Биологические функции воды Вода является универсальным растворителем, в ней растворены почти все химические соединения, входящие в
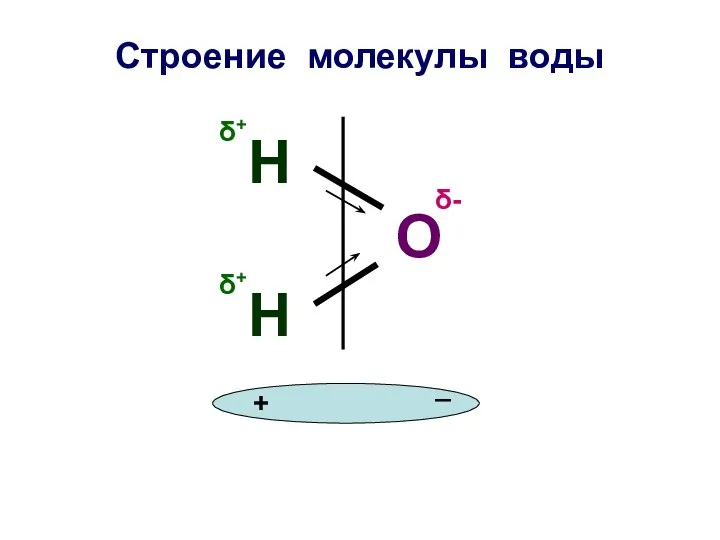
- 4. Строение молекулы воды О Н Н δ+ δ+ δ- + _
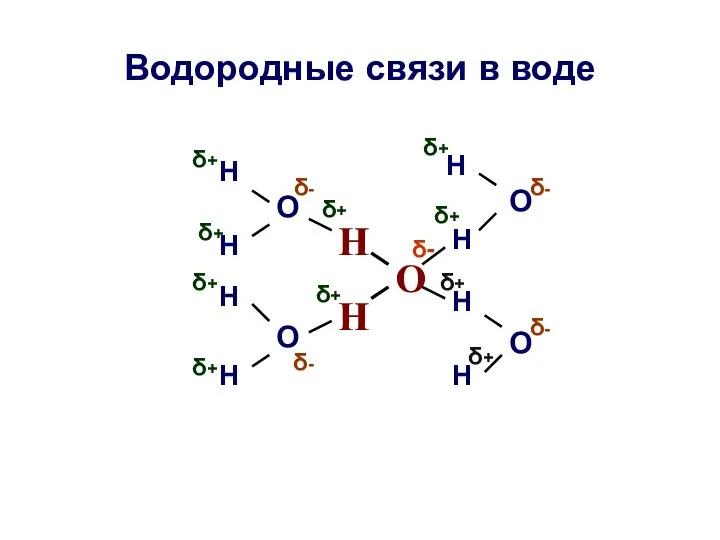
- 5. Водородные связи в воде О Н Н О О Н Н Н Н Н Н Н
- 6. Характеристика водородных связей Водородные связи очень непрочные: они в 10-12 раз слабее ковалентных связей; Время существования
- 7. Количество водородных связей в воде зависит от температуры; При 0°С каждая молекула воды образует водородные связи
- 8. Благодаря огромному количеству водородных связей у воды имеется ряд уникальных свойств, отсутствующих у других жидкостей: Высокая
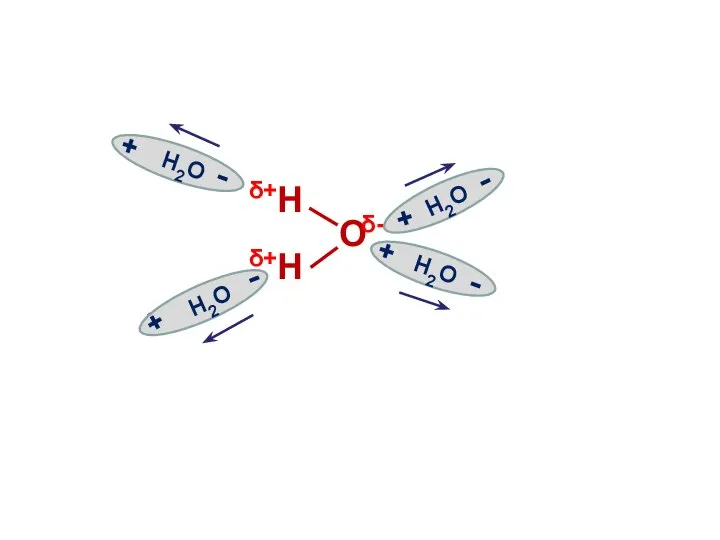
- 9. Электролитическая диссоциация воды Вода является слабым электролитом и подвергается расщеплению под действием соседних молекул с образованием
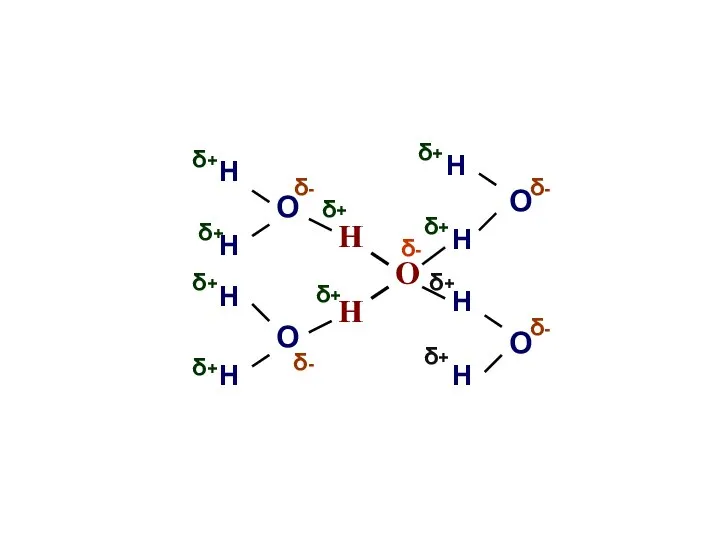
- 10. О Н Н О О Н Н Н Н Н Н Н О Н О δ+
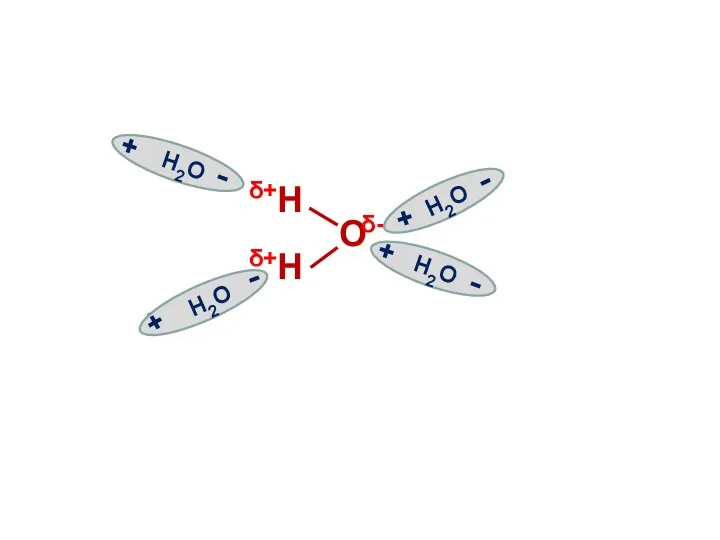
- 11. H H O δ- δ+ δ+ H2O - H2O + - H2O - + + H2O
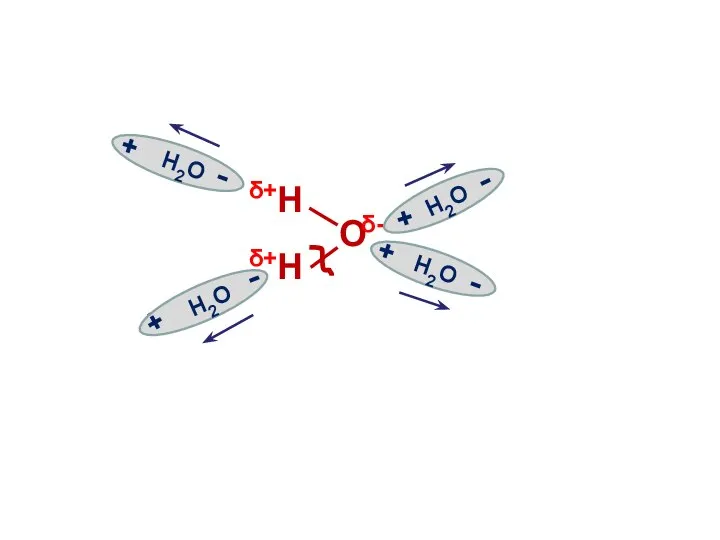
- 12. H H O δ- δ+ δ+ H2O - H2O + - H2O - + + H2O
- 13. H H O δ- δ+ δ+ H2O - H2O + - H2O - + + H2O
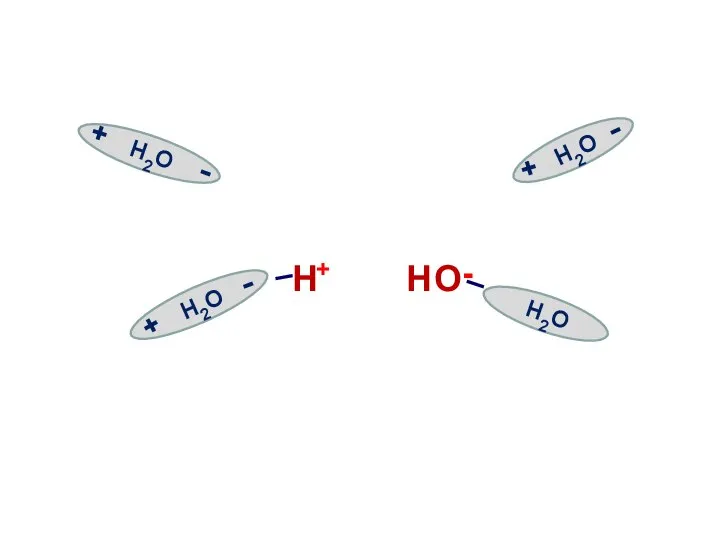
- 14. H H O - + H2O + - H2O + H2O - + + H2O +
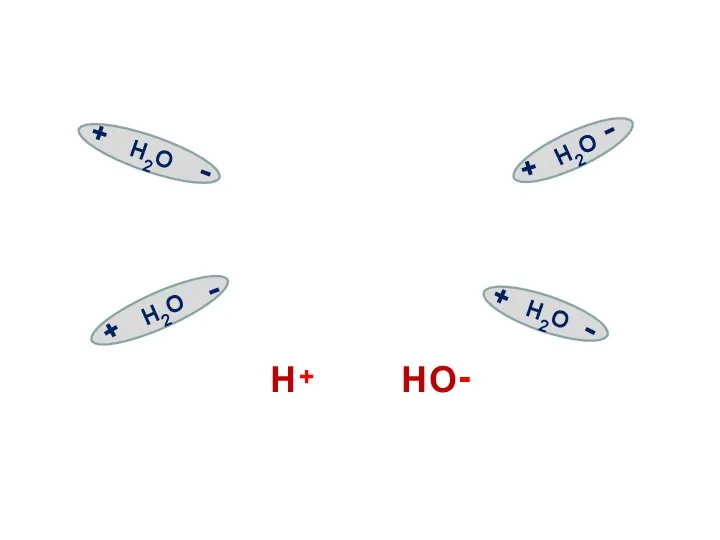
- 15. H2O + - H2O + + H2O - + H2O + - + - H H
- 16. Н2О Н+ + ОН- 55,5 моль/л 1·10-7 моль/л 1·10-7 моль/л
- 17. Однако присутствие ионов водорода и гидроксила даже в очень низких концентрациях существенно влияет на свойства воды
- 18. Водородный показатель – это отрицательный десятичный логарифм концентрации ионов водорода: Водородный показатель = - lg [
- 19. Гидроксильный показатель – это отрицательный десятичный логарифм концентрации ионов гидроксила: рОН = - lg [ОH-] В
- 20. В воде и во всех водных растворах рН + рОН = 14 Ионное произведение воды: [Н+]
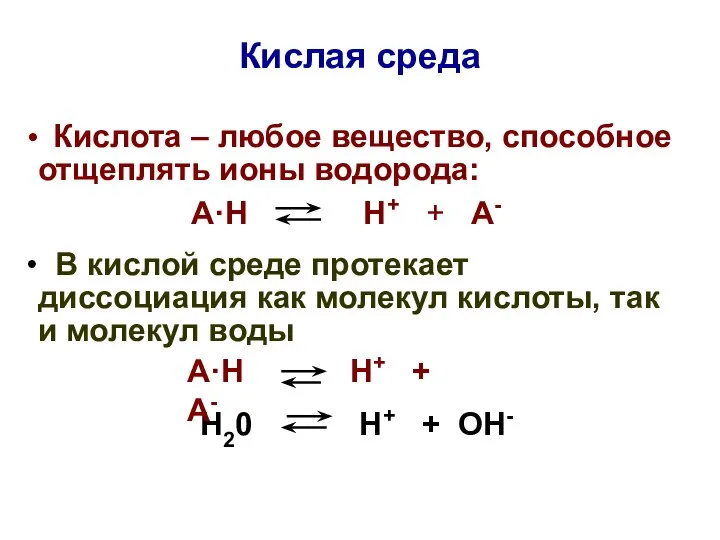
- 21. Кислая среда Кислота – любое вещество, способное отщеплять ионы водорода: А·Н Н+ + А- В кислой
- 22. В кислой среде: [Н+]кисл > [Н+]нейтр > 1·10-7 моль/л рНкисл
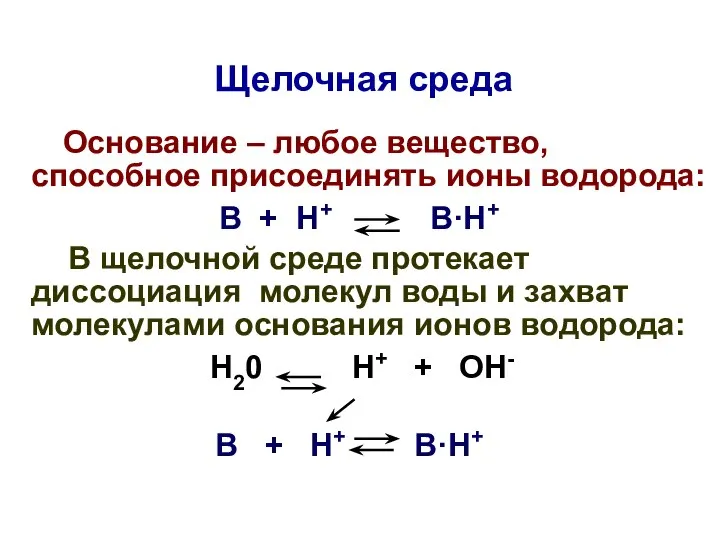
- 23. Щелочная среда Основание – любое вещество, способное присоединять ионы водорода: В + Н+ В·Н+ В щелочной
- 24. В щелочной среде: [Н+]щел рНщел > рНнейтр > 7
- 25. Изменению рН на одну единицу соответствует повышение или снижение кислотности в 10 раз
- 26. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Щ
- 27. Методы определения рН Индикаторные или колориметрические Электрометрические
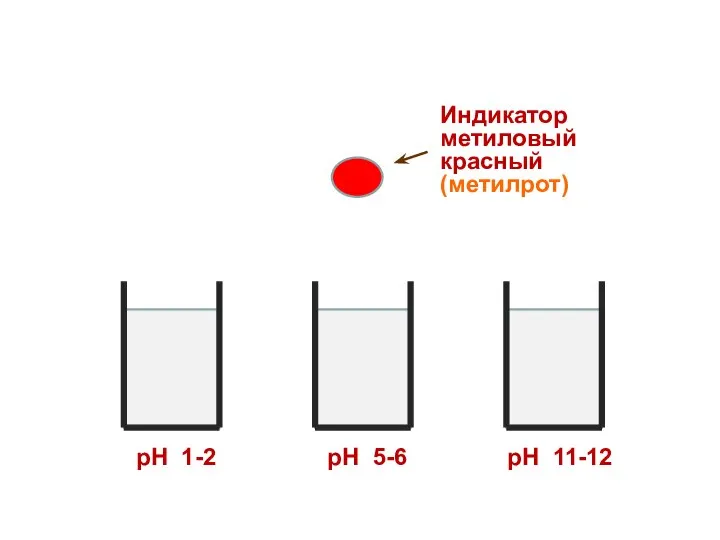
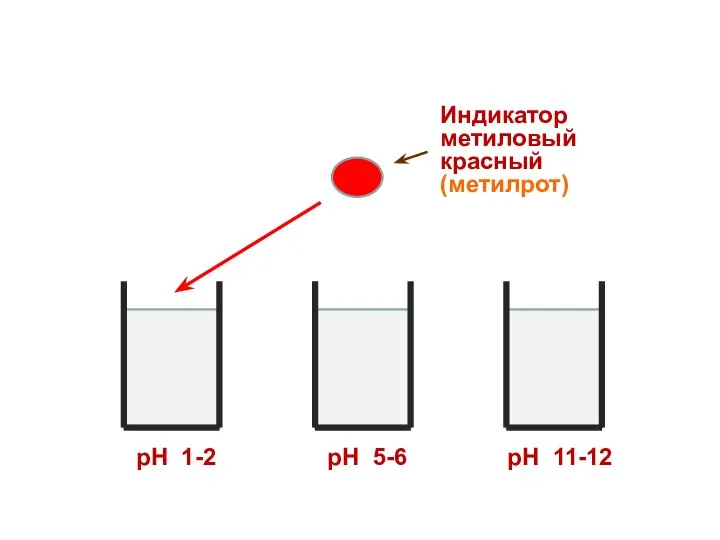
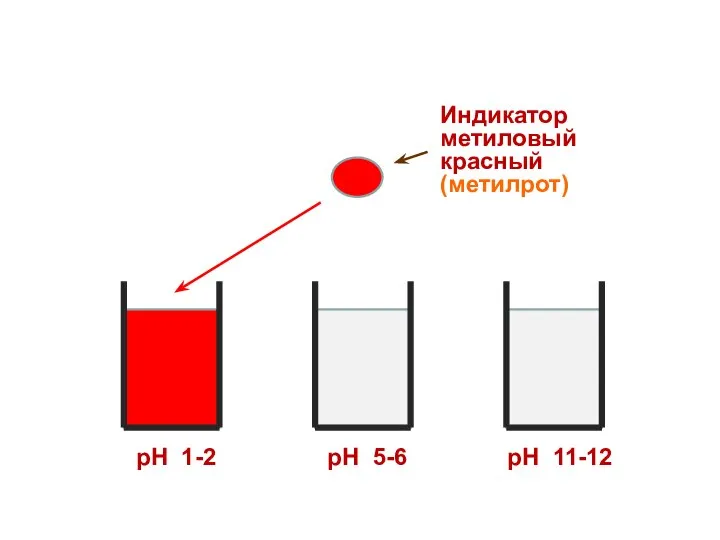
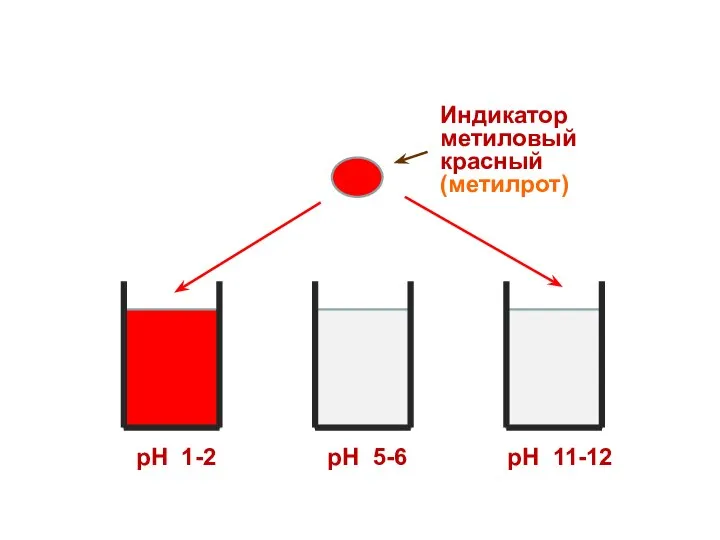
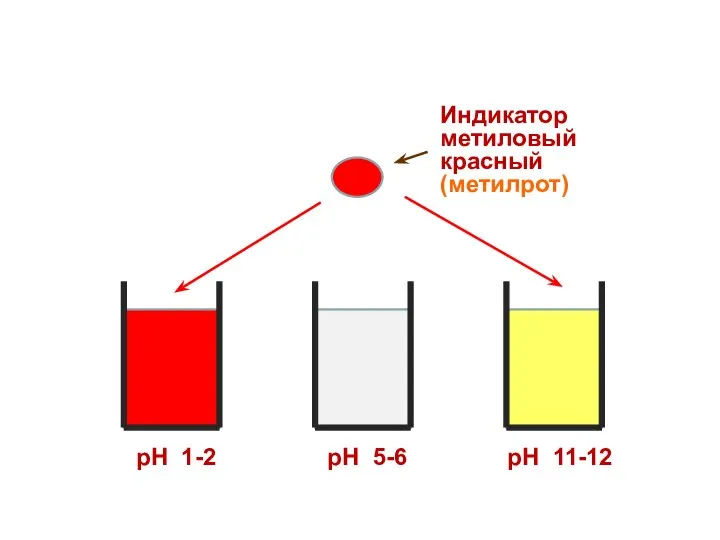
- 28. Индикатор – слабая органическая кислота или основание, у которых диссоциированная и недиссоциированная формы имеют разную окраску:
- 29. Поэтому каждому диапазону кислотности соответствует определенная окраска индикатора.
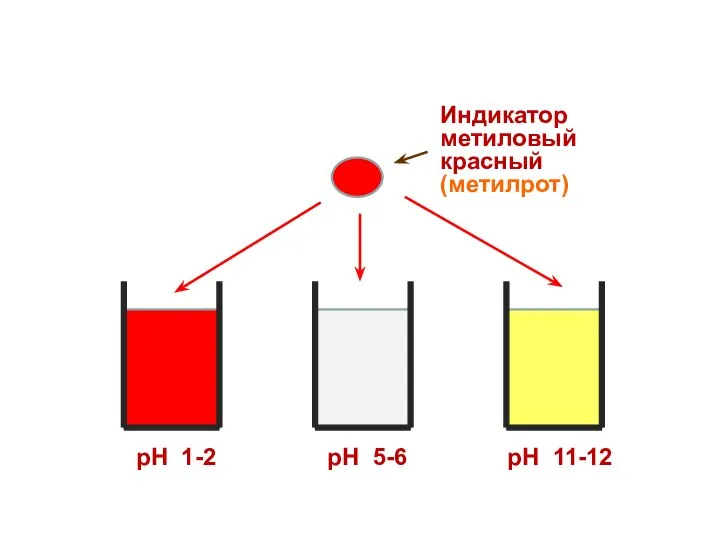
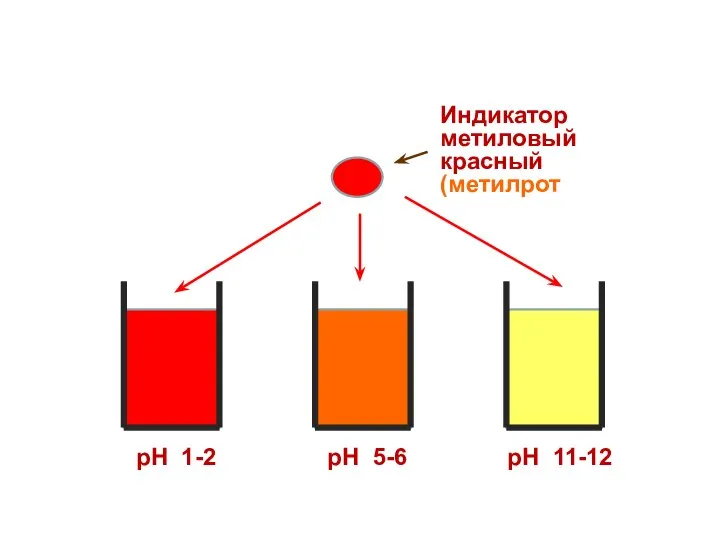
- 30. Индикатор метиловый красный (метилрот) рН 1-2 рН 5-6 рН 11-12
- 31. Индикатор метиловый красный (метилрот) рН 1-2 рН 5-6 рН 11-12
- 32. Индикатор метиловый красный (метилрот) рН 1-2 рН 5-6 рН 11-12
- 33. Индикатор метиловый красный (метилрот) рН 1-2 рН 5-6 рН 11-12
- 34. Индикатор метиловый красный (метилрот) рН 1-2 рН 5-6 рН 11-12
- 35. рН 1-2 рН 5-6 рН 11-12 Индикатор метиловый красный (метилрот)
- 36. рН 1-2 рН 5-6 рН 11-12 Индикатор метиловый красный (метилрот
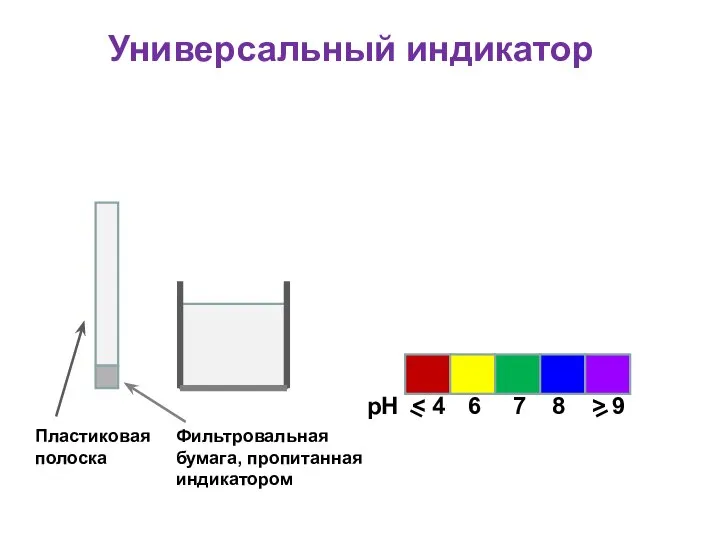
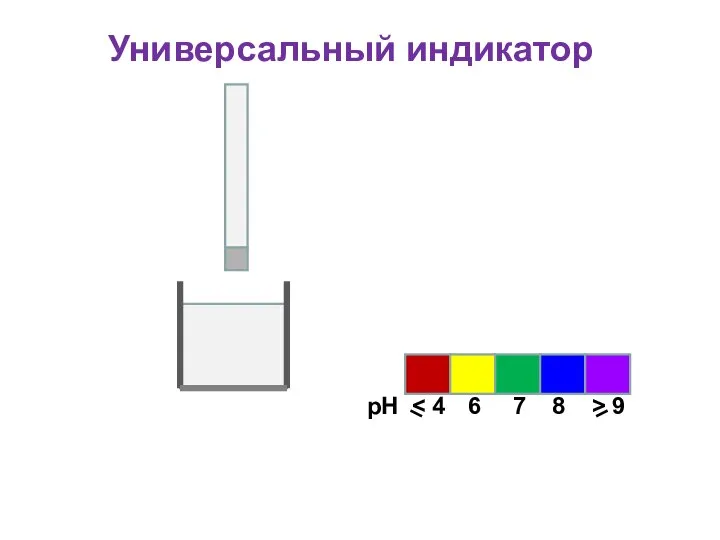
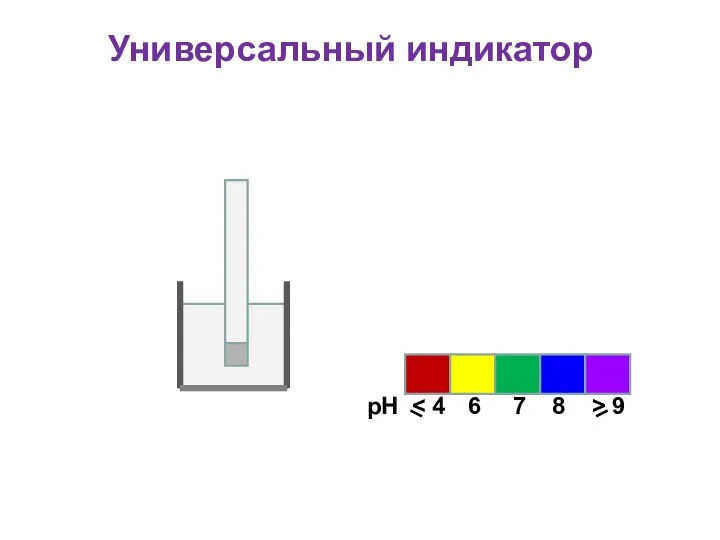
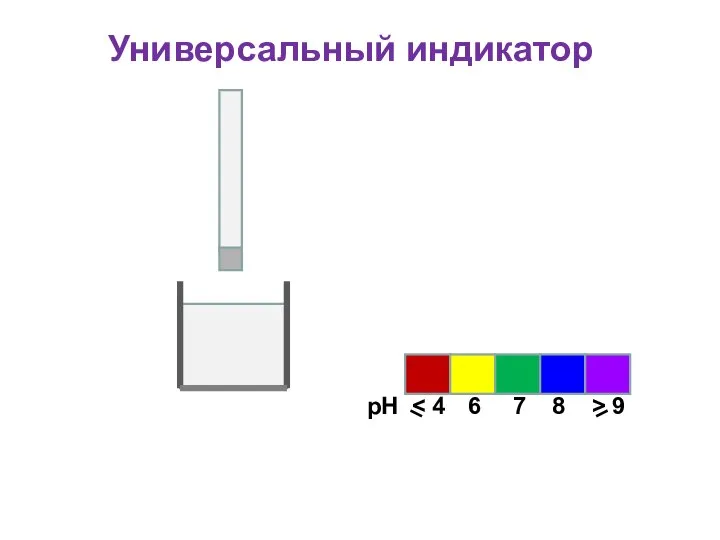
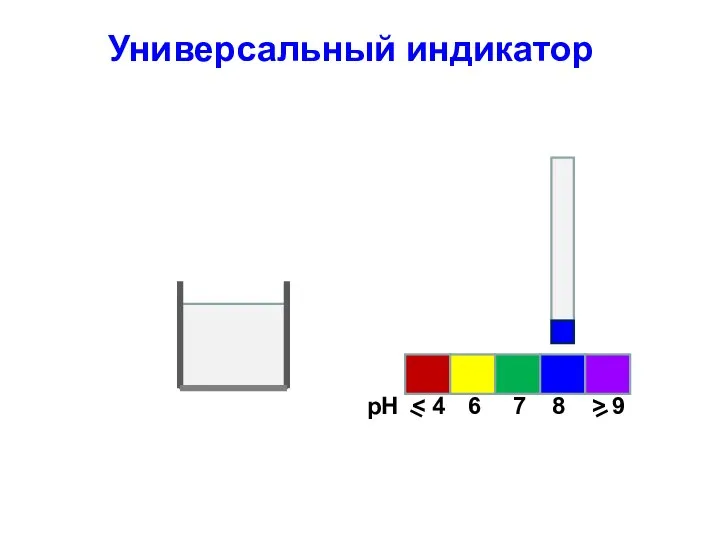
- 37. Универсальный индикатор Для определения кислотности часто используется универсальный индикатор, являющийся смесью нескольких индикаторов с разными зонами
- 38. Универсальный индикатор рН 6 7 8 > 9 Пластиковая полоска Фильтровальная бумага, пропитанная индикатором
- 39. Универсальный индикатор рН 6 7 8 > 9
- 40. Универсальный индикатор рН 6 7 8 > 9
- 41. Универсальный индикатор рН 6 7 8 > 9
- 42. Универсальный индикатор рН 6 7 8 > 9
- 43. Универсальный индикатор рН 6 7 8 > 9
- 44. Электрометрические методы Измерение кислотности проводится с использованием специальных приборов - рН-метров; Главной частью рН-метра является стеклянный
- 45. Буферные растворы Буферные растворы (буферные системы) – растворы способные сохранять постоянное значение рН при добавлении кислоты
- 46. Кислотный компонент – слабая кислота, предназначенная для нейтрализации щелочей; Оснόвный компонент – слабое основание, предназначенное для
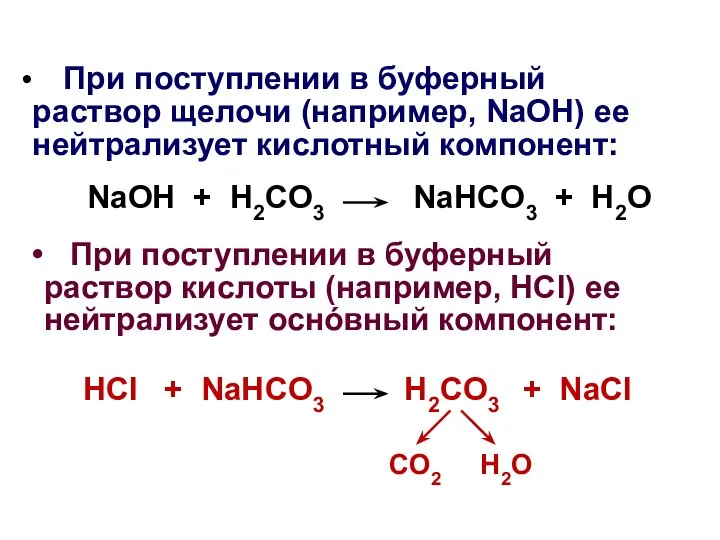
- 47. Бикарбонатный буфер В состав бикарбонатного буфера входит угольная кислота (слабая кислота) и бикарбонат натрия (слабое основание):
- 48. При поступлении в буферный раствор щелочи (например, NaOH) ее нейтрализует кислотный компонент: NaOH + H2CO3 NaHCO3
- 49. Буферная емкость Эффективность буферного действия оценивается буферной емкостью; Буферная емкость – количество молей сильной кислоты (например,
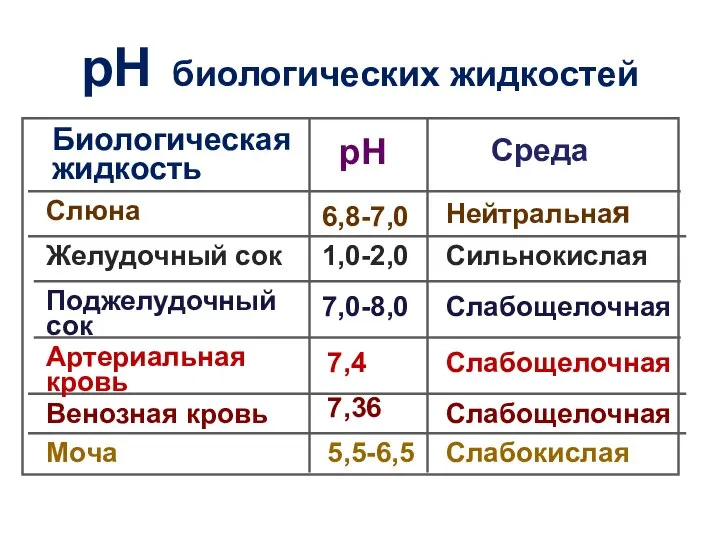
- 50. рН биологических жидкостей Биологическая жидкость рН Среда Слюна 6,8-7,0 Нейтральная Желудочный сок 1,0-2,0 Сильнокислая Поджелудочный сок
- 51. Тест 1 Содержание воды в организме взрослого человека а) 10-20 % б) 30-40 % в) 60-70
- 52. Тест 2 Молекулы воды соединяются друг с другом: а) водородными связями б) донорно-акцепторными в) ионными связями
- 53. Тест 3 Концентрация ионов гидроксила в дистиллированной воде равна: а) 1·10-2 моль/л б) 1·10-7 моль/л в)
- 54. Тест 4 Концентрация ионов водорода в дистиллированной воде равна: а) 1·10-2 моль/л б) 1·10-7 моль/л в)
- 56. Скачать презентацию











![В кислой среде: [Н+]кисл > [Н+]нейтр > 1·10-7 моль/л рНкисл](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406156/slide-21.jpg)
![В щелочной среде: [Н+]щел рНщел > рНнейтр > 7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406156/slide-23.jpg)















 Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Строение и обмен нуклеотидов
Строение и обмен нуклеотидов Пропиновые кислоты
Пропиновые кислоты Ароматты галогентуындылар. Айырылу-қосылу және қосылу айырылу реакциясының механизмі
Ароматты галогентуындылар. Айырылу-қосылу және қосылу айырылу реакциясының механизмі Фации метаморфизма
Фации метаморфизма Мыло. Компоненты мыла
Мыло. Компоненты мыла Водород. Положение в периодической системе
Водород. Положение в периодической системе Электрохимические методы анализа
Электрохимические методы анализа Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов
Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов Строение газообразных, жидких и твердых тел
Строение газообразных, жидких и твердых тел Газообразные вещества
Газообразные вещества Солюбилизация в прямых мицеллах ПАВ
Солюбилизация в прямых мицеллах ПАВ Алкіни
Алкіни  Силикатная промышленность Цели урока – ознакомиться с силикатной промышленностью и основными видами строительных материало
Силикатная промышленность Цели урока – ознакомиться с силикатной промышленностью и основными видами строительных материало Метанол, етанол, гліцерин, їхні молекулярні та структурні формули, фізичні властивості. Функціональна гідроксильна група.
Метанол, етанол, гліцерин, їхні молекулярні та структурні формули, фізичні властивості. Функціональна гідроксильна група.  Исследование фруктовых и овощных соков на наличие в них синтетических красителей и кислотность среды
Исследование фруктовых и овощных соков на наличие в них синтетических красителей и кислотность среды Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 ОГЭ, вопрос 16 1-4
ОГЭ, вопрос 16 1-4 Фенилхромановые соединения. Флавоноиды
Фенилхромановые соединения. Флавоноиды Высокоэффективные добавки для сухих смесей и строительных растворных Evonik. Power to create.
Высокоэффективные добавки для сухих смесей и строительных растворных Evonik. Power to create.  Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Многоатомные спирты
Многоатомные спирты ДОСЛІДЖЕННЯ ДОСЛІДЖЕННЯ НАЙМАСОВІШИХ КУПАННЯ смт
ДОСЛІДЖЕННЯ ДОСЛІДЖЕННЯ НАЙМАСОВІШИХ КУПАННЯ смт Всё о воде
Всё о воде Качественные реакции. Катионы
Качественные реакции. Катионы Применение кислорода
Применение кислорода АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ.
АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. Среднекремнекислые породы
Среднекремнекислые породы