Содержание
- 2. План 1. Титриметрические методы 2. Классификация титриметрических методов анализа 3. Титрованные (стандартные) растворы 4. Способы и
- 3. Закон эквивалентов СМэ1 ∙ V1 = СМэ2 ∙ V2 , где СМэ – молярная концентрация эквивалента;
- 4. Фактор эквивалентности fэ 2NaOH + H2СO3 ↔ Na2СO3 + 2H2O fэ(H2СO3) = ½. NaOH + H2СO3
- 5. Молярной массой эквивалента вещества называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности на
- 6. Классификация титриметрических методов анализа 1. Кислотно-основное титрование – основано на реакции переноса ионов водорода от одной
- 7. 2. Окислительно-восстановительное титрование (редокс-метрия) – основано на реакции переноса электронов от восстановителя к окислителю: Ох1 +
- 8. 3. Осадительное титрование – основано на реакции образования малорастворимых соединений: nКm+ + mАn- ↔ КnАm Различают:
- 9. Способ приготовленного титра Т – титр раствора, г/мл; а – масса навески вещества, г; Vк –
- 10. Способ установленного титра
- 11. Навеску установочного вещества для приготовления определенного объема V раствора с молярной концентрацией СМ или молярной концентрацией
- 12. Прямое титрование CH3COOH + NaOH ↔ CH3COONa + H2O
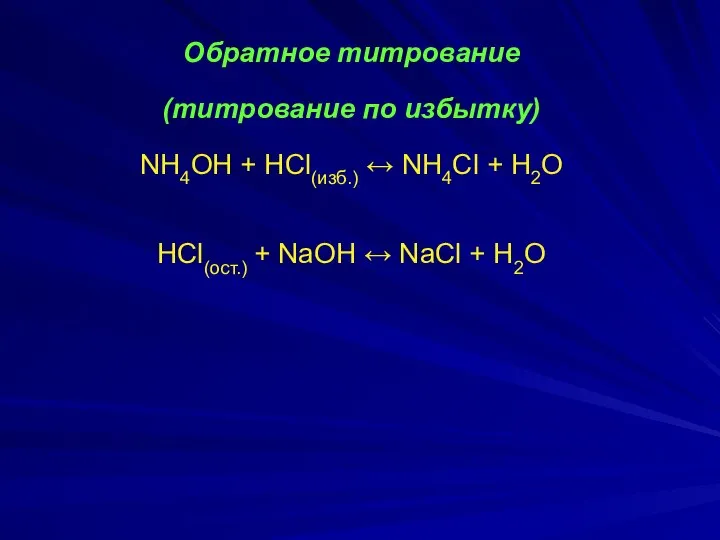
- 13. Обратное титрование (титрование по избытку) NH4ОH + HCl(изб.) ↔ NH4Cl + H2O HCl(ост.) + NaOH ↔
- 14. Заместительное титрование Например, методом алкалиметрии способом прямого титрования Н3PO4 титруется только по 1 и 2 ступеням.
- 15. Различают: метод пипетирования; метод отдельных навесок.
- 16. Сущность кислотно-основного титрования В основе метода кислотно-основного титрования лежат реакции, связанные с переносом ионов водорода между
- 17. Титранты метода КОТ В методе ацидиметрии в качестве титрантов применяют 0,01-1 М растворы кислот (HCl, H2SO4,
- 18. Тетраборат натрия декагидрат, бура (Na2B4O7 ∙10H2O) B4O72- + 2H+ + 5H2O ⇄ 4H3BO3 fэ (Na2B4O7 .
- 19. Карбонат натрия (Na2CO3) CO32- + 2H+ ⇄ H2CO3 fэ (Na2CO3) = ½ индикатор – метиловый красный,
- 20. Щaвeлeвaя киcлотa H2C2O4·2 H2O H2C2O4 + 2OH- ⇄ C2O4 2- + 2H2О fэ (H2C2O4) = ½
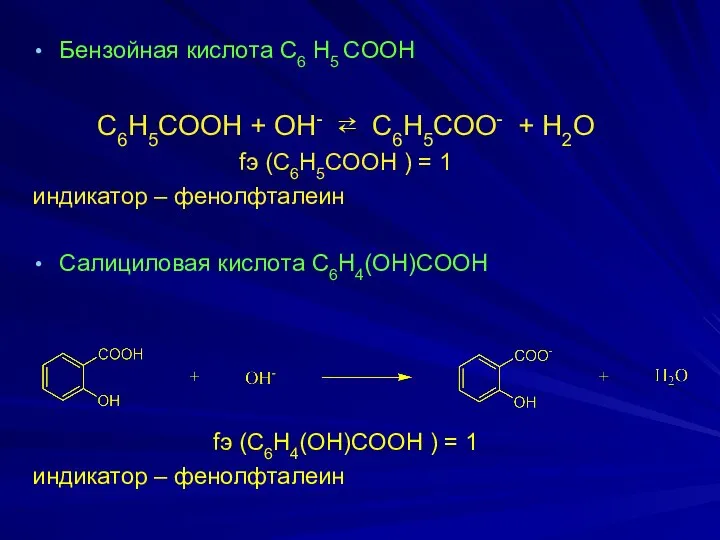
- 21. Бeнзoйнaя киcлoтa C6 H5 COOH C6H5COOH + OH- ⇄ C6Н5СОО- + H2О fэ (C6H5COOH ) =
- 22. ∆рН = рКа ±1 HInd ⇄ H+ + Ind-
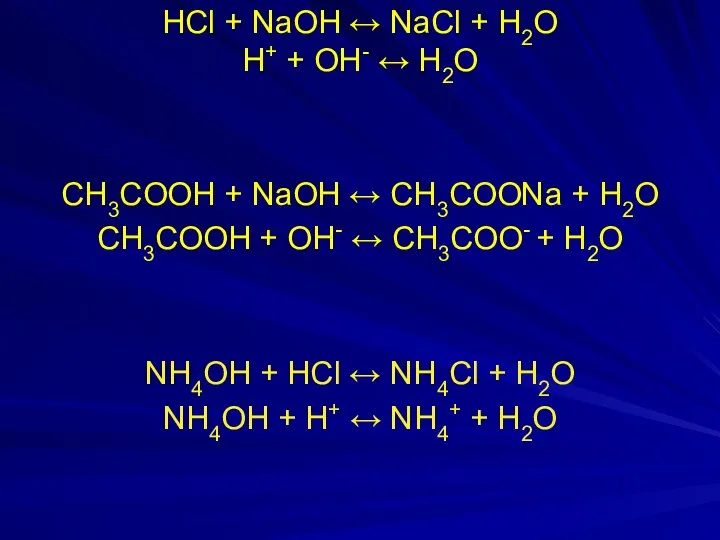
- 23. HCl + NaOH ↔ NaCl + H2O H+ + OH- ↔ H2O CH3COOH + NaOH ↔
- 24. Для построения кривой титрования рассчитывают: рН исходного раствора, рН в момент полунейтрализации, рН в начале скачка
- 25. С визуальным фиксированием конечной точки титрования (КТТ) можно оттитровать вещества, у которых Ка, Кb ≥ 5·10-8
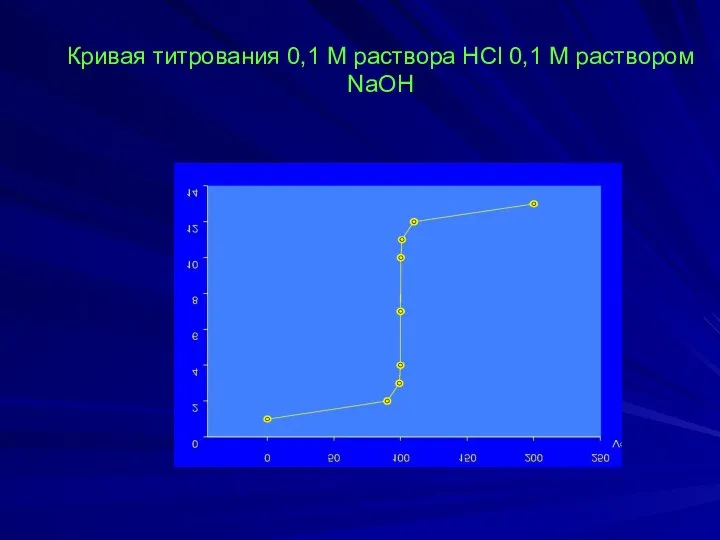
- 26. Кривая титрования 0,1 М раствора HCl 0,1 М раствором NaOH
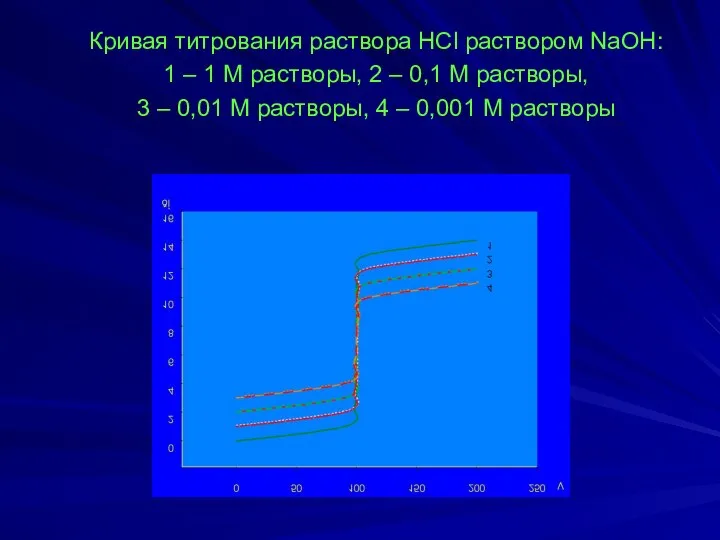
- 27. Кривая титрования раствора HCl раствором NaOH: 1 – 1 М растворы, 2 – 0,1 М растворы,
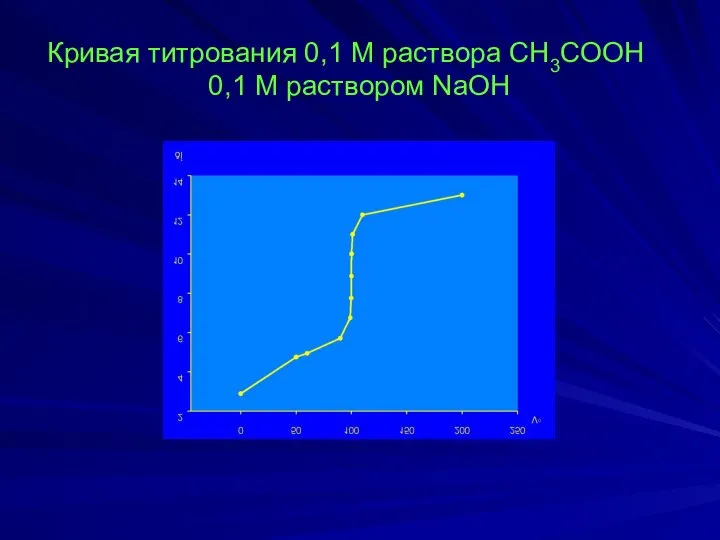
- 28. Кривая титрования 0,1 М раствора CH3COOH 0,1 М раствором NaOH
- 30. Скачать презентацию





















 Перечень практических навыков по общей химии для экзамена
Перечень практических навыков по общей химии для экзамена Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия Водородная связь
Водородная связь Белки́ (протеины, полипепти́ды)
Белки́ (протеины, полипепти́ды) Корозія металів. Засоби захисту від корозії
Корозія металів. Засоби захисту від корозії  Липиды. Классификация, строение, свойства, биологическая роль
Липиды. Классификация, строение, свойства, биологическая роль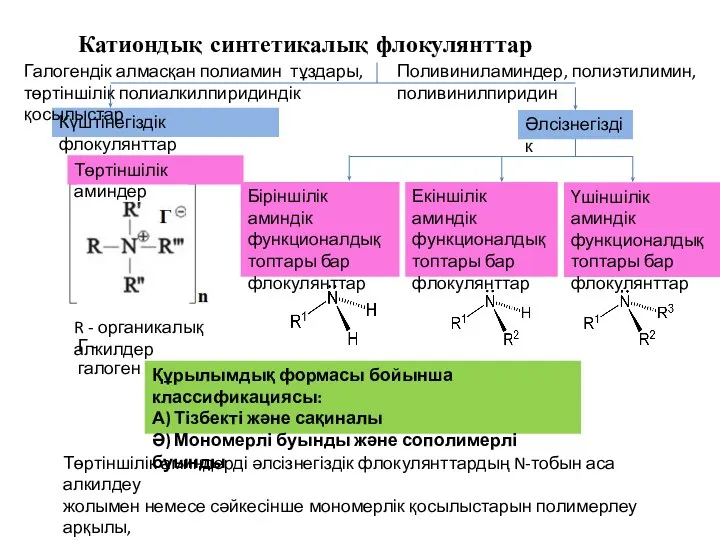 Катиондық синтетикалық флокулянттар
Катиондық синтетикалық флокулянттар Технология получения полиуретанов
Технология получения полиуретанов Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации The application nanotechnology in chemistry
The application nanotechnology in chemistry Алкины
Алкины Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид
Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид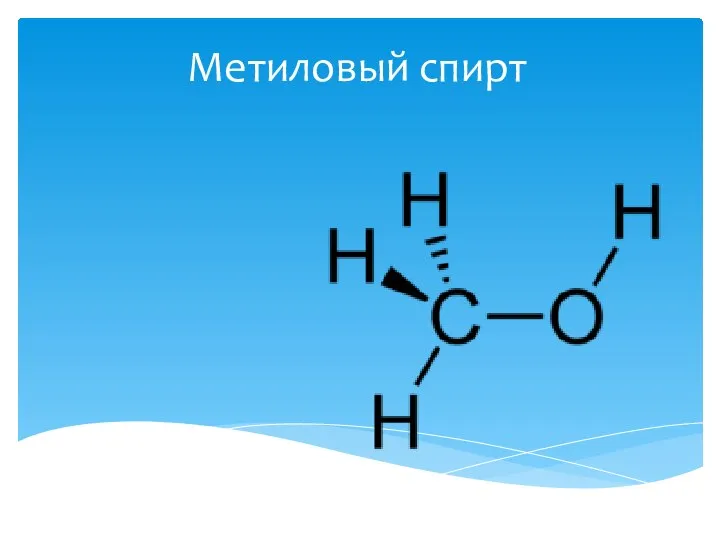 Метиловый спирт
Метиловый спирт Химия s-элементов. Особенности свойств Mg и Be. Химия p-элементов. Общая характеристика элементов VIIA группы (галогены). Фтор
Химия s-элементов. Особенности свойств Mg и Be. Химия p-элементов. Общая характеристика элементов VIIA группы (галогены). Фтор Алкены
Алкены Анализ объектов окружающей среды. Сопоставление и выбор методов анализа
Анализ объектов окружающей среды. Сопоставление и выбор методов анализа Polymerase chain reaction
Polymerase chain reaction Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна
Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна  Тағам қоспалары
Тағам қоспалары Аттестационная работа. Методическая разработка по выполнению проекта Краски из природных материалов
Аттестационная работа. Методическая разработка по выполнению проекта Краски из природных материалов Супрамолекулярная химия
Супрамолекулярная химия Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты
Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты  Мономеры для получения полиэфиров (лекция 10)
Мономеры для получения полиэфиров (лекция 10) Средства для борьбы с насекомыми
Средства для борьбы с насекомыми Введение в химию биологически активных веществ. (Тема 1)
Введение в химию биологически активных веществ. (Тема 1) Карбоновые кислоты
Карбоновые кислоты Адам ағзасында кездесетін химиялық элементтер
Адам ағзасында кездесетін химиялық элементтер Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11)