Содержание
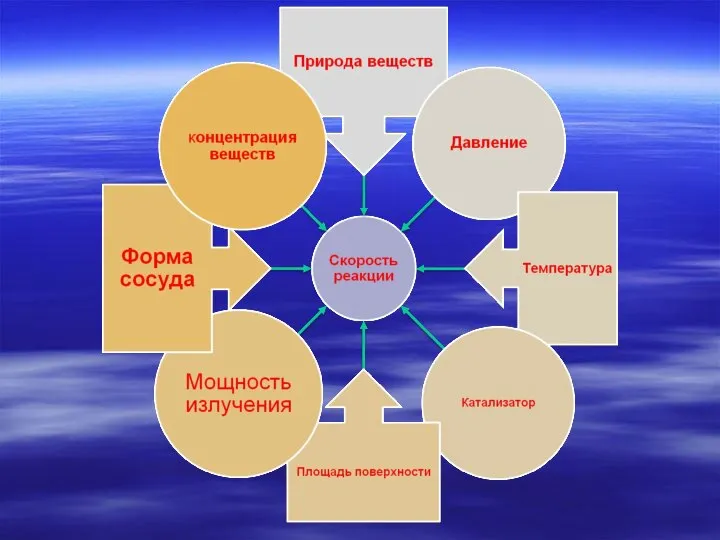
- 2. Химической кинетикой называют учение о скорости химических реакций и зависимости ее от различных условий – природы
- 3. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени
- 6. Влияние концентрации. Скорость гомогенной реакции, протекающей при постоянной температуре, прямо пропорциональна произведению концентраций реагирующих веществ. υ
- 7. Влияние температуры Согласно правилу Вант-Гоффа, при повышении температуры на каждые 10оС скорость реакции увеличивается в 2-4
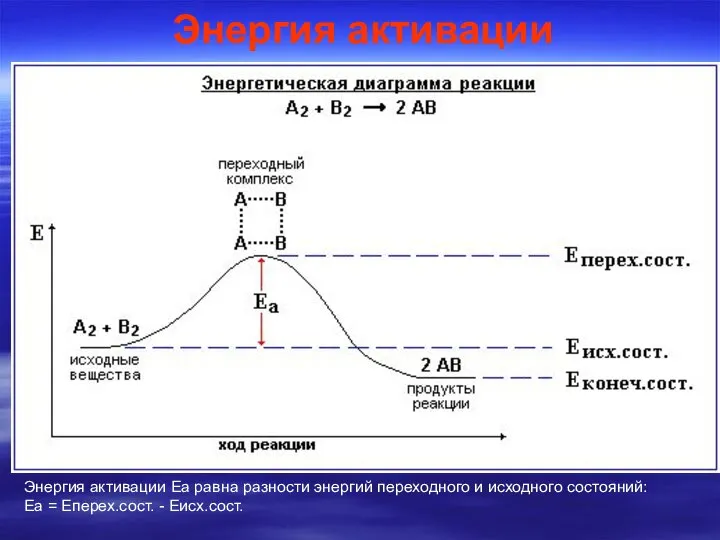
- 8. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового
- 9. Энергия активации Энергия активации Еа равна разности энергий переходного и исходного состояний: Еа = Еперех.сост. -
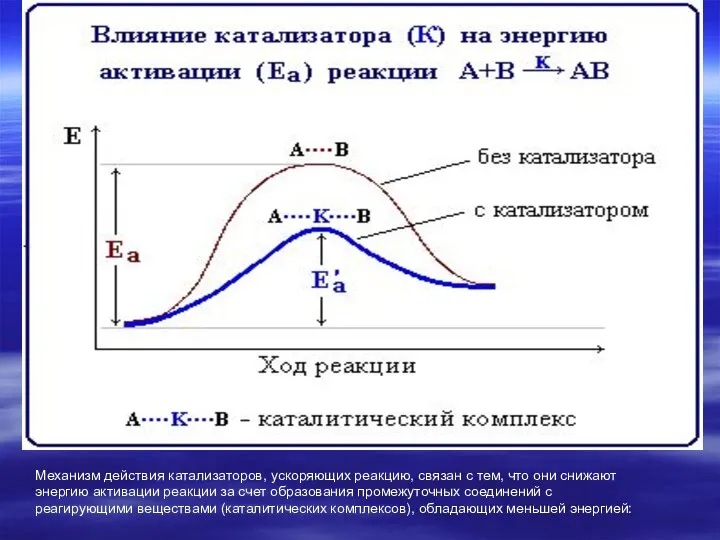
- 10. Влияние катализатора Катализаторы – вещества, которые могут активизировать реакцию или изменять ее скорость, но не изменяют
- 11. Механизм действия катализаторов, ускоряющих реакцию, связан с тем, что они снижают энергию активации реакции за счет
- 12. Селективность катализатора Cпособность ускорять одну из возможных при данных условиях параллельных реакций. Благодаря этому можно, применяя
- 13. Ингибиторы Механизм действия ингибиторов аналогичен механизму действия катализаторов – они участвуют в промежуточных стадиях процесса. Следствием
- 14. Сложные химические реакции
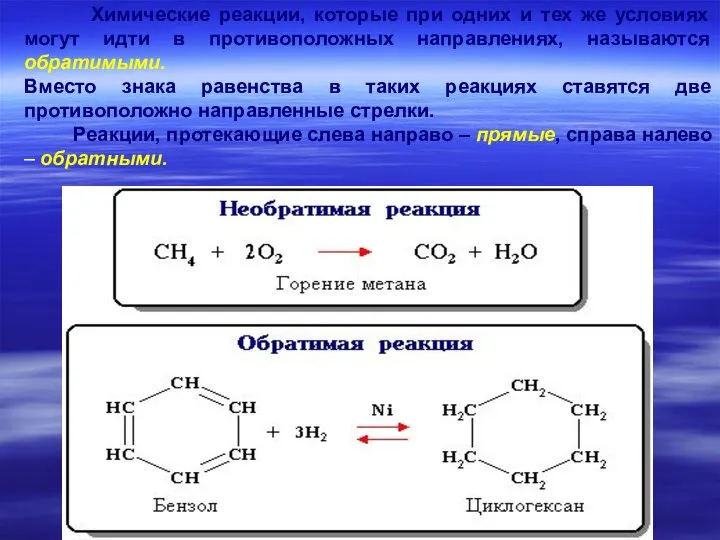
- 15. Виды сложных реакций Обратимые – реакция идет в двух направлениях: прямом и обратном NH4CNO↔(NH2)2CO (получение карбамида)
- 16. Цепные реакции Цепные – это реакции, состоящие из ряда последовательных стадий, когда активные частицы, образующиеся в
- 17. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми.
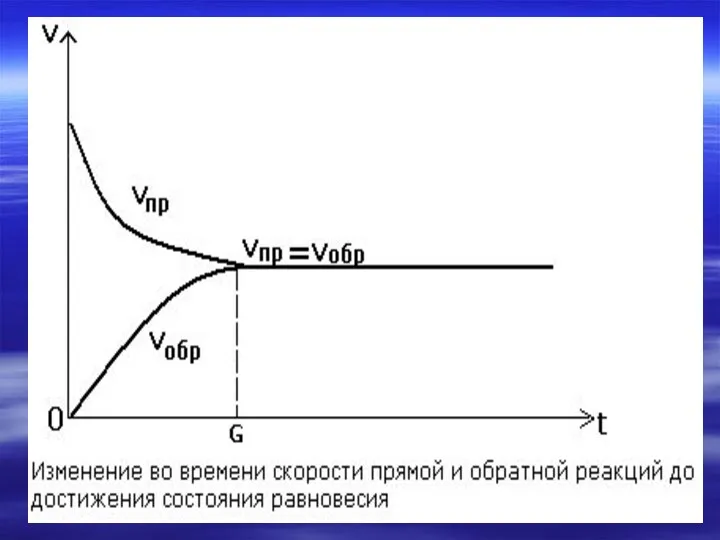
- 18. Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
- 20. Анри-Луи Ле Шателье (1850—1936) — член Парижской академии наук, президент Французского химического общества — широко известен
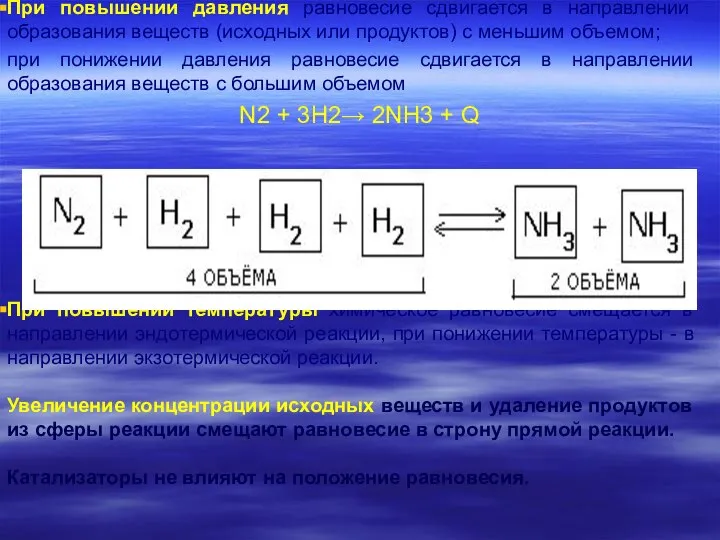
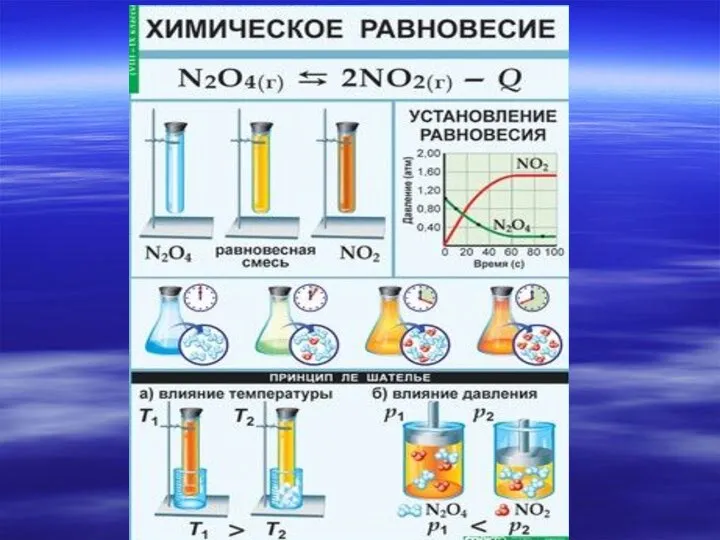
- 21. Принцип Ле Шателье Направление сдвига равновесия в общем виде определяется принципом Ле Шателье: Если находящаяся в
- 22. При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при
- 23. Рассмотрим применение принципа Ле Шателье к различным типам воздействия: 1. Увеличение концентрации исходных веществ и удаление
- 25. Список используемых источников Глинка Н.Л. Общая химия: Учебное пособие для вузов/Под ред. А.И. Ермакова. – М.:
- 26. Скорость химической реакции не зависит от: а) концентрации реагирующих веществ; б) температуры ; в) концентрации продуктов
- 27. Какой из законов является основополагающим в области химической кинетики: а) закон постоянства состава; б) закон объемных
- 28. На состояние химического равновесия, как правило, не влияет: а) изменение давления; б) изменение температуры; в) использование
- 29. На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 625 раз при температурном коэффициенте
- 30. В каком случае система приходит в состояние химического равновесия: а) при оптимальном давлении в системе; б)
- 31. Чем объясняется повышение скорости реакции при введении в систему катализатора: а) уменьшением энергии активации; б) увеличением
- 32. Назовите вещества, снижающие скорость химической реакции: а) катализаторы; б) окислители; в) ингибиторы; г) красители.
- 34. Скачать презентацию
























 ПРИРОДНЫЕ И ПОПУТНЫЕ ГАЗЫ.
ПРИРОДНЫЕ И ПОПУТНЫЕ ГАЗЫ. Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно
Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно Примерная рабочая программа основного общего образования предмета Химия
Примерная рабочая программа основного общего образования предмета Химия Геохимия агроландшафтов
Геохимия агроландшафтов Гiдроксикислоти. Номенклатура
Гiдроксикислоти. Номенклатура Native elements
Native elements Классы неорганических соединений
Классы неорганических соединений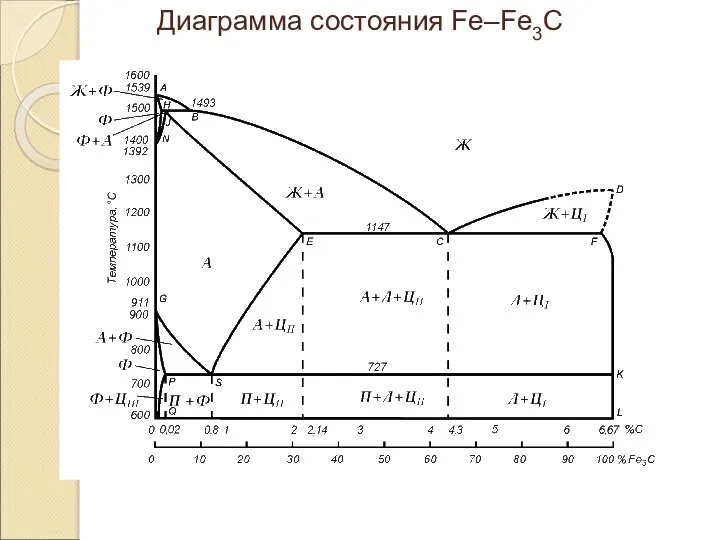 Диаграмма состояния Fe–Fe3C
Диаграмма состояния Fe–Fe3C Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф
Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва
Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва Природные и синтетические полимеры. Способы получения полимеров
Природные и синтетические полимеры. Способы получения полимеров Майда еритін витаминдер. А,D,E,K витаминдері
Майда еритін витаминдер. А,D,E,K витаминдері Контроль результатов обучения химии
Контроль результатов обучения химии Көмірсулар
Көмірсулар Metals
Metals Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Нуклеотиды Нуклеотиды Нуклеиновые кислоты
Нуклеотиды Нуклеотиды Нуклеиновые кислоты  Дисперсные системы
Дисперсные системы Процессы нитрования
Процессы нитрования Основания. Химические свойства оснований
Основания. Химические свойства оснований Кобальт. Химический элемент
Кобальт. Химический элемент Оценка срока службы для полимерных материалов методами термического анализа
Оценка срока службы для полимерных материалов методами термического анализа Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Методы выращивания кристаллов. Метод Киропулуса
Методы выращивания кристаллов. Метод Киропулуса Топливо и топливосжигающие устройства. Горение топлива
Топливо и топливосжигающие устройства. Горение топлива Гидроксид железа
Гидроксид железа Химия элементов VIA группы. SO2
Химия элементов VIA группы. SO2 Гидролиз солей
Гидролиз солей