Содержание
- 2. Тема: Реакции ионного обмена в водных растворах электролитов. Ионные реакции и уравнения. Диссоциация воды. Водородный показатель.
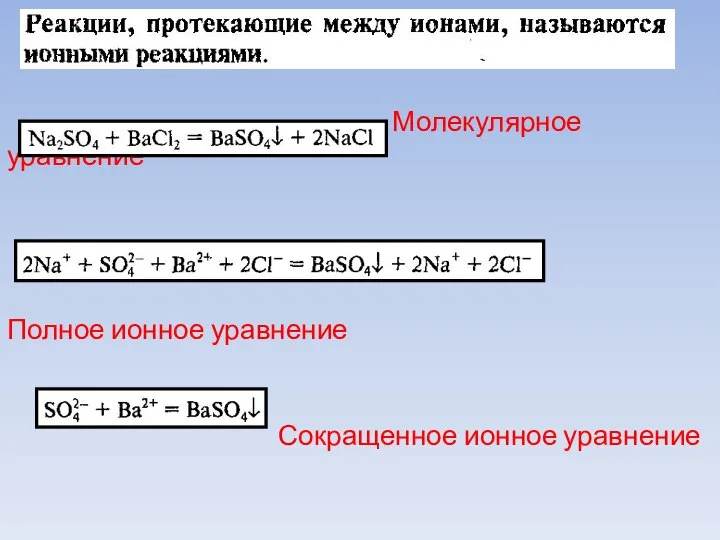
- 3. Реакции ионного обмена в водных растворах электролитов. Ионные реакции и уравнения.
- 4. Молекулярное уравнение Полное ионное уравнение Сокращенное ионное уравнение
- 5. «Правила» написания ионных уравнений В ионных уравнениях формулы веществ записываются в виде ионов или в виде
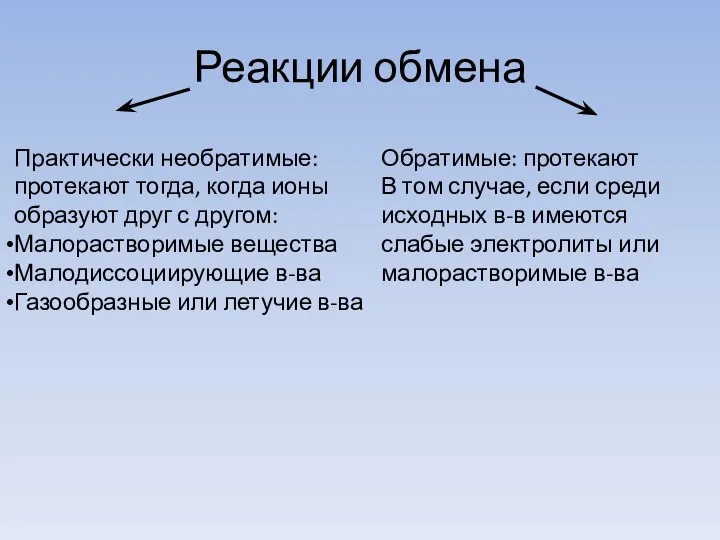
- 7. Реакции обмена Практически необратимые: протекают тогда, когда ионы образуют друг с другом: Малорастворимые вещества Малодиссоциирующие в-ва
- 8. Практически необратимые реакции
- 9. Обратимые реакции
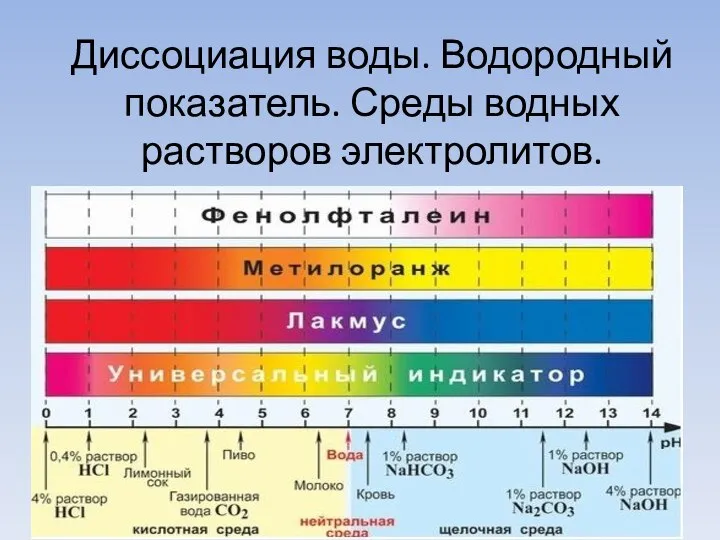
- 11. Диссоциация воды. Водородный показатель. Среды водных растворов электролитов.
- 12. Уравнение диссоциации воды С учетом гидратации ионов: Без учета гидратации ионов: Из уравнения видно, что концентрация
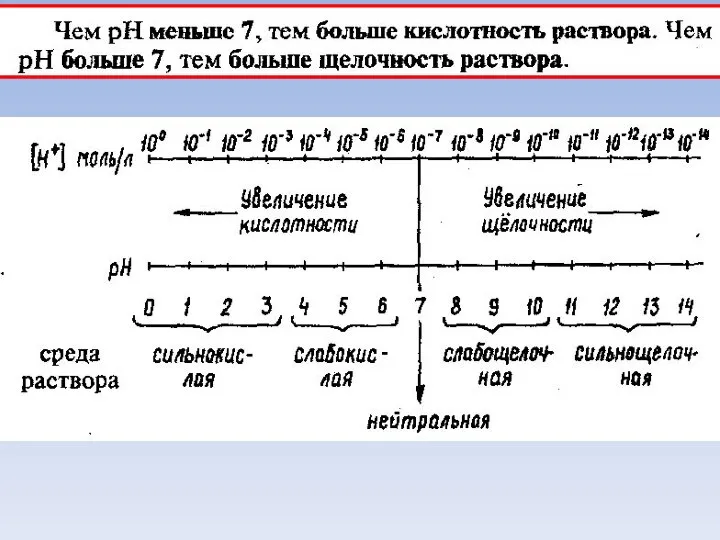
- 13. Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды: Среду водного раствора можно охарактеризовать концентрацией
- 14. Три типа сред: Нейтральная среда Кислая среда: Щелочная среда:
- 15. Для характеристики сред растворов удобно использовать водородный показатель pH Например:
- 17. Качественно характер среды водных растворов электролитов определяют с помощью индикаторов. Лакмус Метиловый оранжевый Фенолфталеин
- 19. Гидролиз солей.
- 20. Сущность гидролиза сводится к: Химическому взаимодействию катионов или анионов соли с гидроксид-ионами или ионами водорода из
- 21. Для большинства солей гидролиз процесс обратимый. Количественно он характеризуется степенью гидролиза. Степень гидролиза зависит: Природы соли
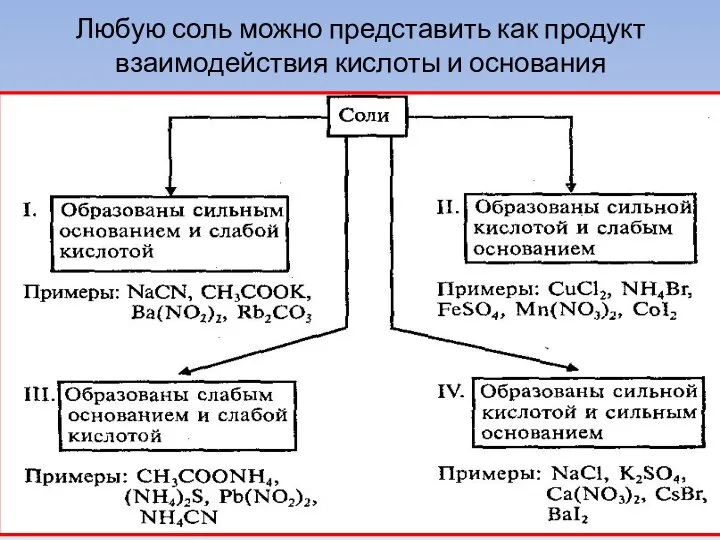
- 22. Любую соль можно представить как продукт взаимодействия кислоты и основания
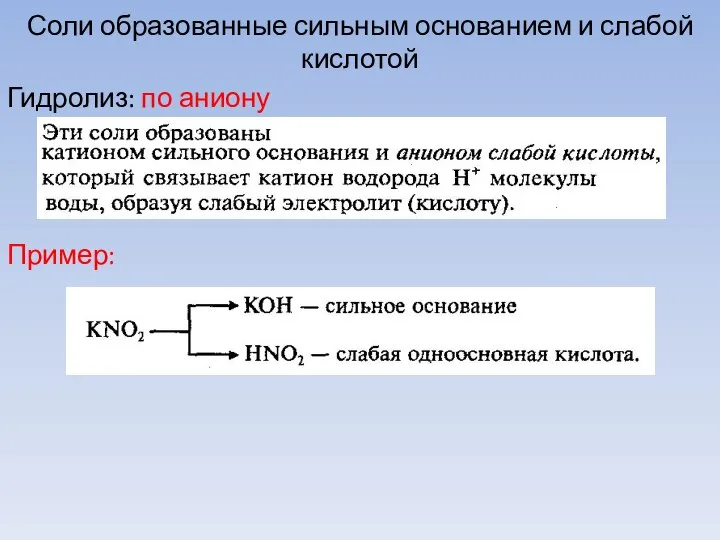
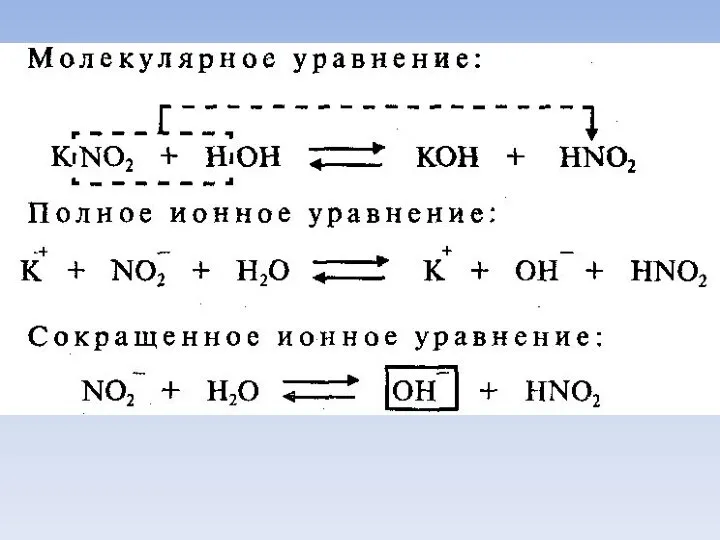
- 23. Соли образованные сильным основанием и слабой кислотой Гидролиз: по аниону Пример:
- 25. Механизм:
- 26. Соли образованные слабым основанием и сильной кислотой Гидролиз: по катиону Пример:
- 28. Соли образованные слабым основанием и слабой кислотой Гидролиз: по катиону и по аниону Пример 1:
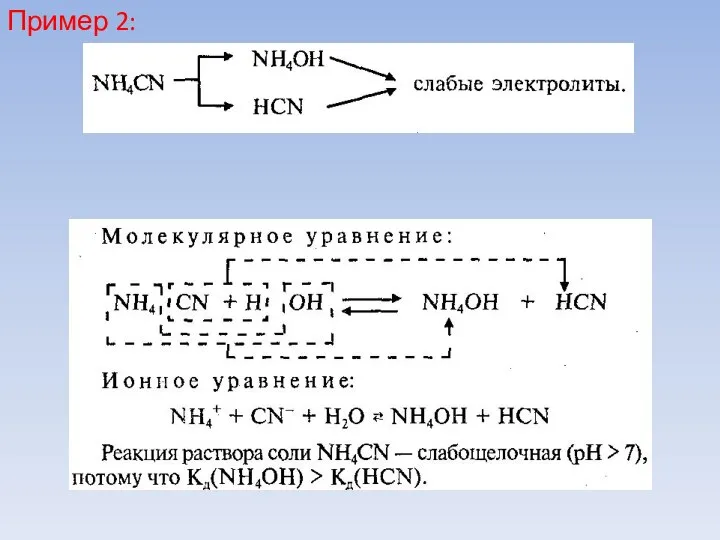
- 30. Пример 2:
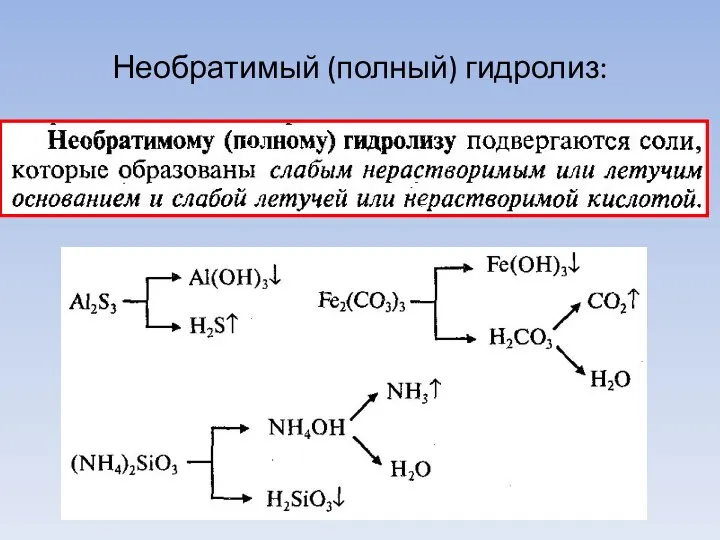
- 31. Необратимый (полный) гидролиз:
- 32. Пример:
- 34. Скачать презентацию






















 Хімічні добавки. Е-числа
Хімічні добавки. Е-числа Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі
Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Пластичний обмін
Пластичний обмін  Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть
Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть  Биохимия нервной ткани. Биологические мембраны
Биохимия нервной ткани. Биологические мембраны амины 10 класс
амины 10 класс Поверхневі явища. Адсорбція
Поверхневі явища. Адсорбція Водородные соединения неметаллов
Водородные соединения неметаллов Аттестационная работа: Сравнение показателей качества меда разных производителей
Аттестационная работа: Сравнение показателей качества меда разных производителей Уравнение температурного режима реактора
Уравнение температурного режима реактора Хімія і медицина
Хімія і медицина  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Окислительно-восстановительные реакции Миронова Елена Анатольевна учитель химии МБОУ СОШ №7 г. Дубна Московской области 2013 го
Окислительно-восстановительные реакции Миронова Елена Анатольевна учитель химии МБОУ СОШ №7 г. Дубна Московской области 2013 го Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Производные фенола: танины
Производные фенола: танины Ферменты (энзимы). (Тема 4)
Ферменты (энзимы). (Тема 4) ПОЧЕМУ СОЛИ СОЛЕНЫЕ ?
ПОЧЕМУ СОЛИ СОЛЕНЫЕ ? Весь курс химии. Кратко
Весь курс химии. Кратко Проект: жило-было мыло
Проект: жило-было мыло Происхождение химических элементов
Происхождение химических элементов Распределительная хроматография
Распределительная хроматография Кислоты и основания
Кислоты и основания Технологии повышения конструкционной прочности сталей
Технологии повышения конструкционной прочности сталей Современные проблемы геологии. Изотопный взгляд на проблему
Современные проблемы геологии. Изотопный взгляд на проблему Гравиметрические методы анализа
Гравиметрические методы анализа Химическая организация клетки
Химическая организация клетки