Содержание
- 2. Цель Изучение проблемы коррозии металлов и исследование коррозийной стойкости металлов и способов их защиты
- 3. Задачи изучить литературу по теме исследований; исследовать коррозийную устойчивость оксидных пленок: сделать вывод о защитных свойствах
- 4. Новизна исследования Исследование коррозийной стойкости металлов и объяснение её с точки зрения электродных потенциалов
- 5. Коррозия Самопроизвольное разрушение металлов и металлических материалов (сплавов) под воздействием окружающей среды называется коррозией Существуют разные
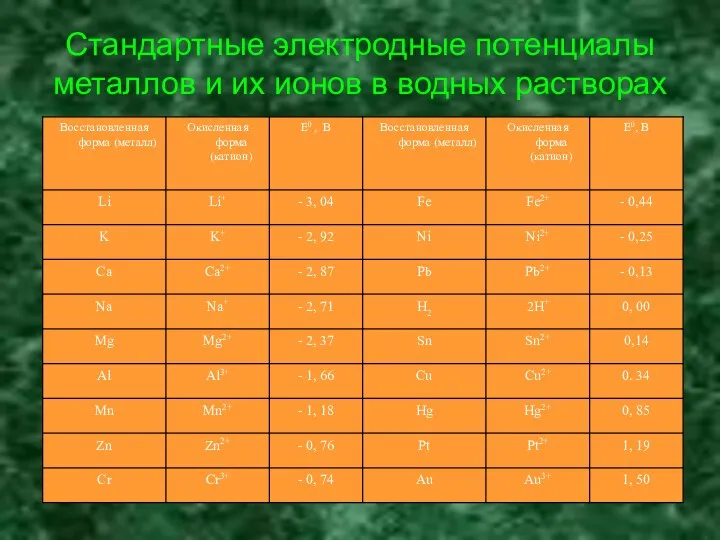
- 6. Электродный потенциал Электродный потенциал является важной количественной характеристикой восстановительных свойств металла и окислительных свойств его иона.
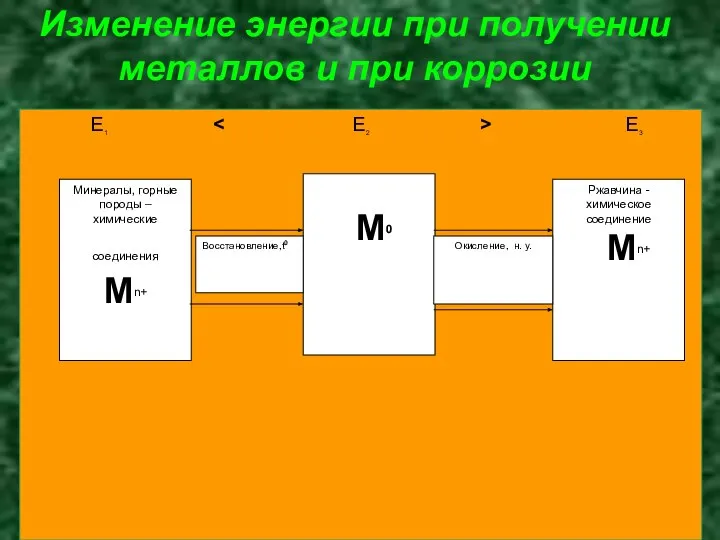
- 7. Изменение энергии при получении металлов и при коррозии E1 E3 Минералы, горные породы – химические соединения
- 8. Стандартные электродные потенциалы металлов и их ионов в водных растворах
- 9. Химическая коррозия Химическая коррозия- это вид коррозии, обусловленный непосредственным взаимодействием металла или сплава с сухими газами,
- 10. Электрохимическая коррозия Электрохимическая коррозия - наиболее рапространённый вид коррозии, приносящий наибольший вред металлам и изделиям из
- 11. Методы борьбы с коррозией
- 12. Опыт №1 Испытание коррозийной устойчивости оксидных плёнок Объект исследования: стальная пластинка длиной 25 см, шириной 2
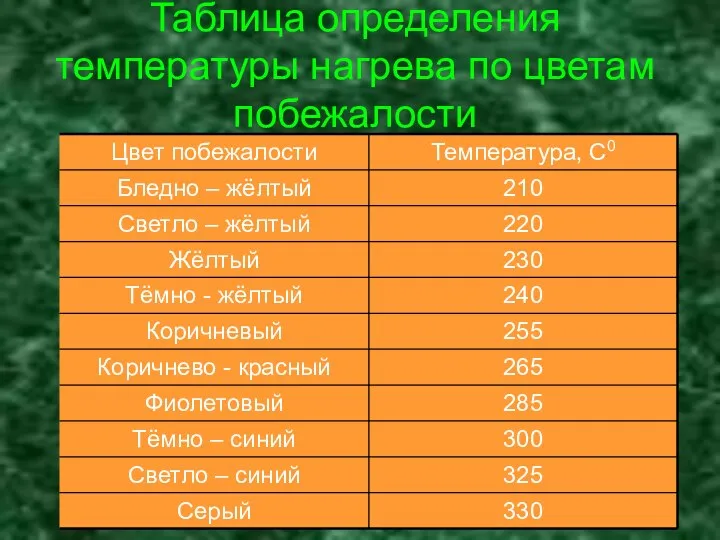
- 13. Цвета побежалости
- 14. Таблица определения температуры нагрева по цветам побежалости
- 15. Медные пятна на стальной пластинке
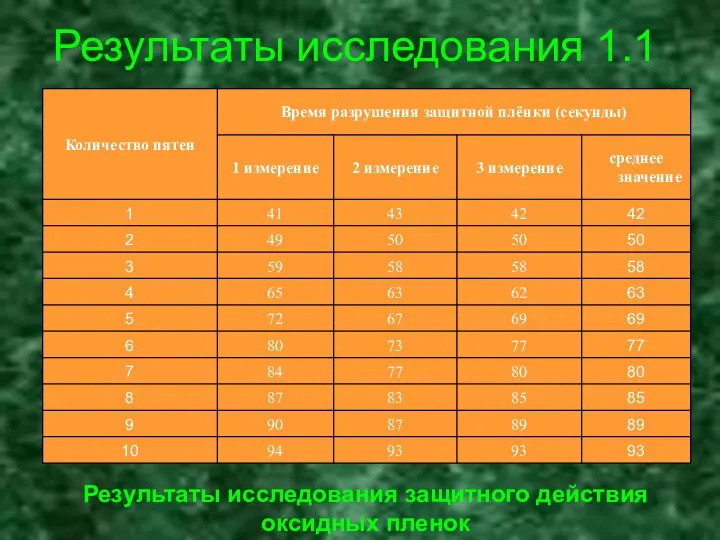
- 16. Результаты исследования 1.1 Результаты исследования защитного действия оксидных пленок
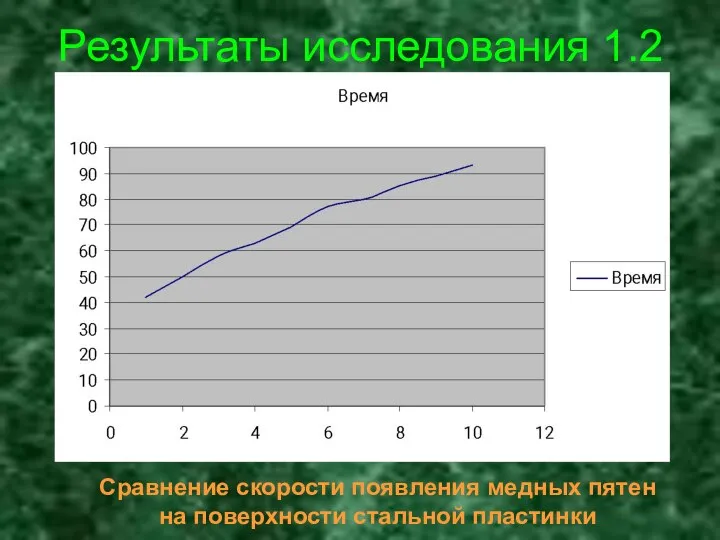
- 17. Результаты исследования 1.2 Сравнение скорости появления медных пятен на поверхности стальной пластинки
- 18. Опыт №2 Коррозия оцинкованного железа и луженой жести Объекты исследования: пластинки стальные, цинковые и оловянные. Методика
- 19. Коррозия оцинкованного железа и лужёной жести Стакан №1 Стакан №2
- 20. Результаты исследования 2.1 Стакан №1 а) система Zn – Fe: А (-) Zn e- → Zn2+
- 21. Результаты исследования 2.2 Стакан №2 б) система Fe – Sn: К(+)Sn → 2 e- + 2H+
- 22. Опыт №3 Электрохимическая защита металлов от коррозии (протекторная защита) Объект исследования: стальной стрежень (зачищенный наждачной бумагой,
- 23. Стаканы с растворами хлорида натрия
- 24. Установка для определения радиуса действия протектора
- 25. Появление синего пятна Образование турнбулевой сини вследствие взаимодействия красной кровяной соли с железом в степени окисления
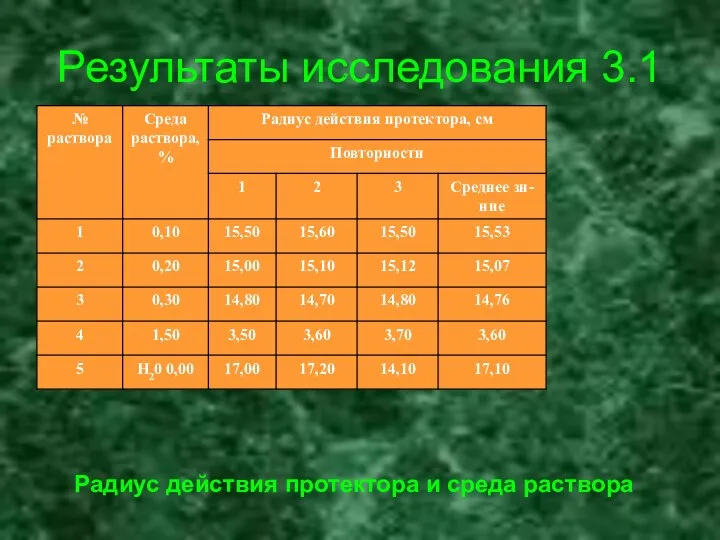
- 26. Результаты исследования 3.1 Радиус действия протектора и среда раствора
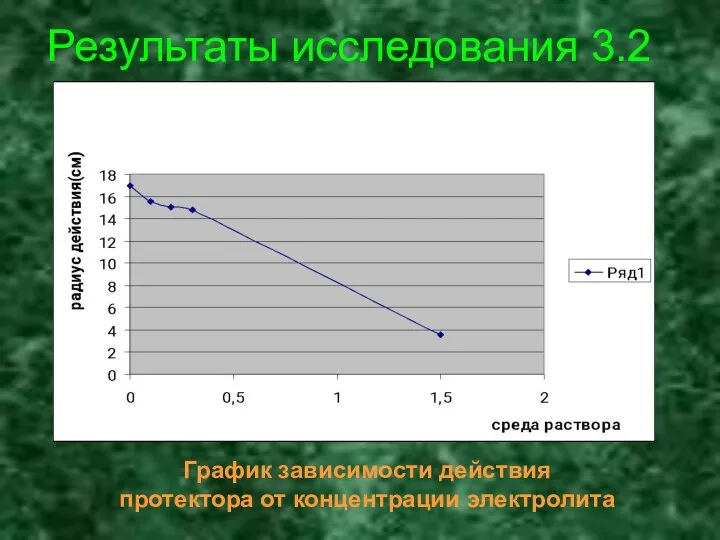
- 27. Результаты исследования 3.2 График зависимости действия протектора от концентрации электролита
- 28. Заключение 1. Проведено исследование коррозийной устойчивости оксидных плёнок (результаты оформлены в таблице и был начерчен график
- 29. Заключение 2. Исходя из опыта (испытание коррозийной устойчивости оксидных плёнок) можно сделать вывод, чем тоньше оксидная
- 30. Заключение 3. По результатам проведения опыта (оксидирование стальных изделий) нами было выяснено, оксидированные металлические пластинки менее
- 31. Заключение 4. Нами было проведено сравнение оцинкованного железа и луженой жести, в ходе которого выяснено, что
- 32. Заключение 5. В опыте действие цинкового протектора при защите стали в растворах хлорида натрия различной концентрации,
- 33. Исследование проводили: Махонин Владислав Николаевич Сулимов Павел Андреевич Научный руководитель: Шахова Татьяна Николаевна
- 35. Скачать презентацию

























 Катализаторы на носителях, получаемые методом пропитки
Катализаторы на носителях, получаемые методом пропитки Изобутан. Получение и применение
Изобутан. Получение и применение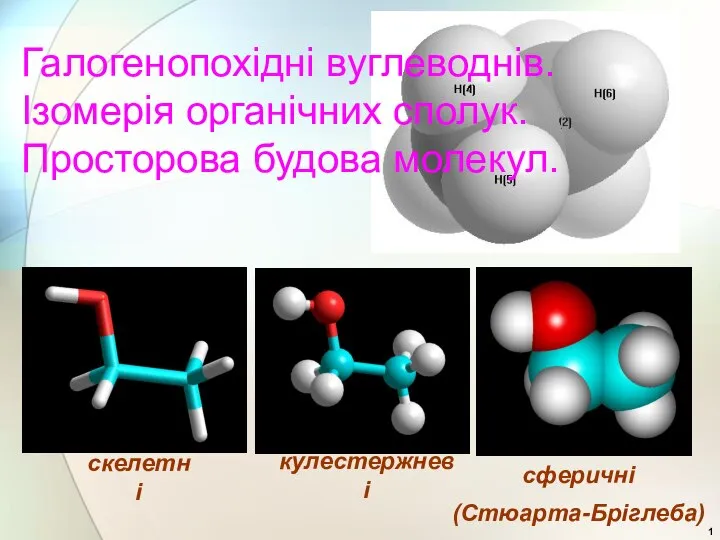 Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул
Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул Планарные потенциометрические сенсоры на основе пилларарена -DNS-162
Планарные потенциометрические сенсоры на основе пилларарена -DNS-162 В глубине кристалла (11 класс)
В глубине кристалла (11 класс) Кинетика гетерогенно-каталитических реакций. (Лекция 22)
Кинетика гетерогенно-каталитических реакций. (Лекция 22) Предмет кристаллографии. Связь с другими науками. История развития
Предмет кристаллографии. Связь с другими науками. История развития Кислород. Получение в лаборатории
Кислород. Получение в лаборатории Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы" - скачать смотреть бесплат
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы" - скачать смотреть бесплат Последствия применения удобрений в сельском хозяйстве
Последствия применения удобрений в сельском хозяйстве Альдегидная функциональная группа
Альдегидная функциональная группа Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Синтетические моющие средства
Синтетические моющие средства Аттестационная работа. Программа элективного курса Исследовательская проектная деятельность при изучении химии
Аттестационная работа. Программа элективного курса Исследовательская проектная деятельность при изучении химии Дать характеристику новому классу органических веществ
Дать характеристику новому классу органических веществ Опасные химикаты
Опасные химикаты Проект «Волшебство химии»
Проект «Волшебство химии» Chimie bioorganique
Chimie bioorganique Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Тұздар гидролизі
Тұздар гидролизі Дисперсные системы и растворы
Дисперсные системы и растворы Сложные эфиры. Жиры. Мыло
Сложные эфиры. Жиры. Мыло Экологическая эффективность-зеленые решения
Экологическая эффективность-зеленые решения Природні джерела вуглеводнів Виконала Учениця 11-А класу Кузнєцова Анастасія
Природні джерела вуглеводнів Виконала Учениця 11-А класу Кузнєцова Анастасія  Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Презентация по Химии "АЛЬТЕРНАТИВНЫЕ ИСТОЧНИКИ ЭЛЕКТРОЭНЕРГИИ" - скачать смотреть бесплатно
Презентация по Химии "АЛЬТЕРНАТИВНЫЕ ИСТОЧНИКИ ЭЛЕКТРОЭНЕРГИИ" - скачать смотреть бесплатно Биоэлементы. Соотношение химических элементов в клетке
Биоэлементы. Соотношение химических элементов в клетке Биохимия и молекулярная биология. Биоэнергетика (лекция 12)
Биохимия и молекулярная биология. Биоэнергетика (лекция 12)