Содержание
- 2. Закон сохранения массы веществ. Химические уравнения. 1748 г – Михаил Васильевич Ломоносов 1789 г – Антуан
- 3. Закон сохранения массы веществ. Химические уравнения. 1748 - Михаил Васильевич Ломоносов 1789 г. - Антуан Лавуазье
- 4. масса реагентов = массе продуктов реагенты продукты
- 5. Закон сохранения массы веществ. Химические уравнения. Химическое уравнение – это условная запись химической реакции посредством химических
- 6. Формулы простых веществ записываются символом без индекса, кроме: H2 N2 O2 F2 Cl2 Br2 I2 Формулы
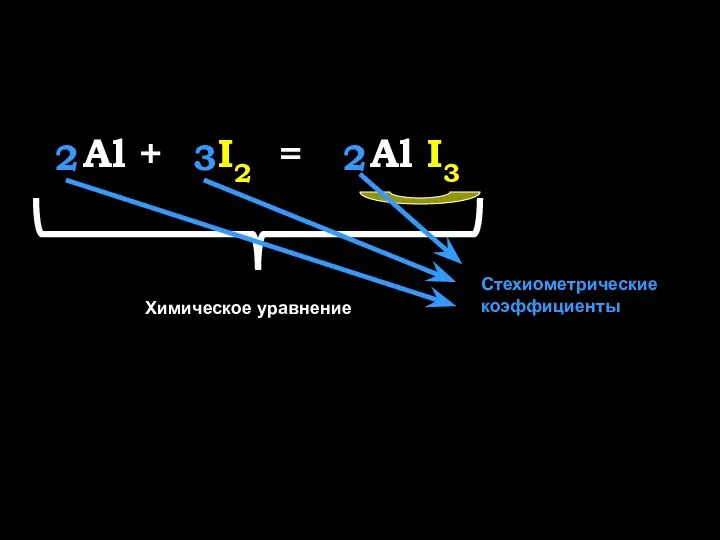
- 7. При взаимодействии алюминия с йодом образовался иодид алюминия . + Al I2 Al I Al I2
- 8. Al + I2 = Al I3 2 2 3 Химическое уравнение Стехиометрические коэффициенты
- 9. Na + S → Na2S Na + N2 → Na3N H2 +N2 → NH3 Pb +
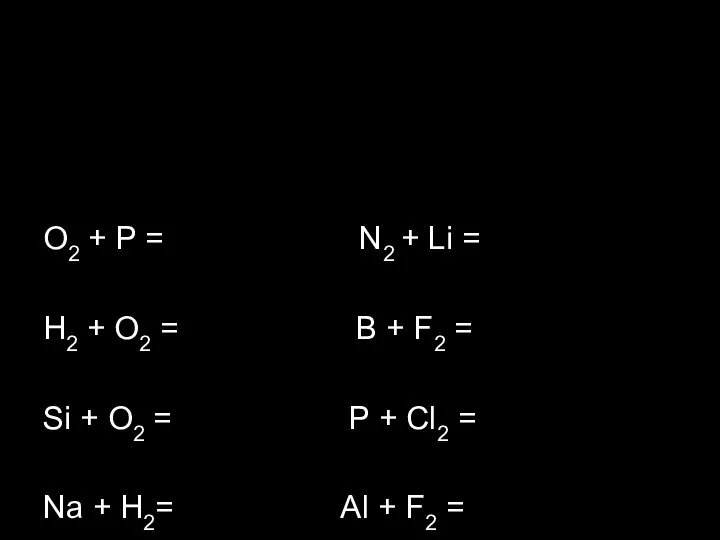
- 10. O2 + P = N2 + Li = H2 + O2 = B + F2 =
- 11. Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
- 12. Горение простых веществ – это взаимодействие простого вещества с кислородом О2 при котором образуется оксид P
- 13. Д.З.: § 14, 15, № 4 стр. 47
- 14. Расставьте коэффициенты и определите тип химической реакции 1) N2 + H2 → NH3 2) CuCl2 +
- 15. Расставьте коэффициенты в следующих схемах реакций, укажите тип реакции: а) NH3 → N2 + H2 б)
- 16. Бинарные соединения можно получить при взаимодействии простых веществ.
- 17. Определите валентность марганца в следующих соединениях: Mn2O7, MnO2, MnCl2, MnO. Составьте формулы соединений по валентности. KS,
- 18. 4) Преобразуйте схемы в уравнения реакций, укажите тип реакции: а) KClO3 → KCl + O2 б)
- 19. 4) Преобразуйте схемы в уравнения реакций, укажите тип реакции: а) KClO3 → KCl + O2 б)
- 21. Скачать презентацию
















 Аттестационная работа. Образовательная программа дополнительного образования «Нанотехнологии»
Аттестационная работа. Образовательная программа дополнительного образования «Нанотехнологии» Химический элементы в нашей жизни
Химический элементы в нашей жизни Гидротермальные месторождения. (Лекция 10)
Гидротермальные месторождения. (Лекция 10) Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика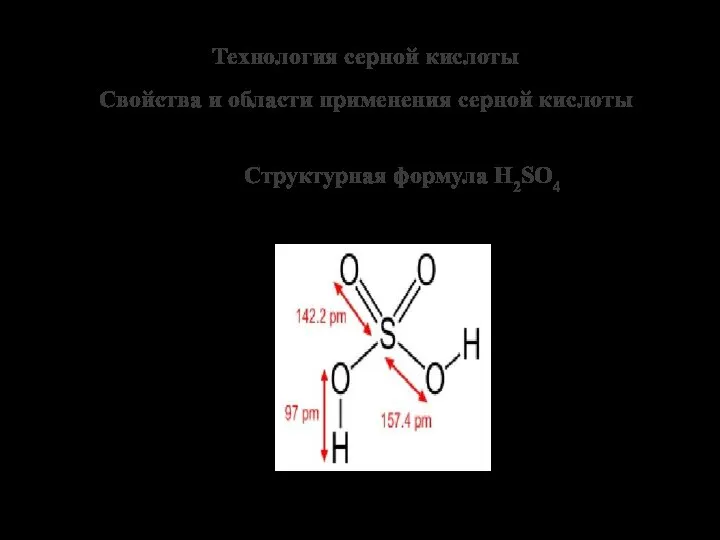 Технология серной кислоты. Свойства и области применения серной кислоты
Технология серной кислоты. Свойства и области применения серной кислоты Классификация высокомолекулярных соединений
Классификация высокомолекулярных соединений Физико-химические методы анализа
Физико-химические методы анализа Олигосахариды
Олигосахариды  Химическая термодинамика биологических процессов
Химическая термодинамика биологических процессов . Зонная модель электронной проводимости металлов С точки зрения электропроводности все вещества могут быть разделены на металлы (61036105)Ом-1 см-1, полупроводники = 102109 Ом1· см1 и диэлектрики 10101022 Ом1· см1. Качественное ра
. Зонная модель электронной проводимости металлов С точки зрения электропроводности все вещества могут быть разделены на металлы (61036105)Ом-1 см-1, полупроводники = 102109 Ом1· см1 и диэлектрики 10101022 Ом1· см1. Качественное ра Классификация неорганических веществ
Классификация неорганических веществ Определение химического элемента на основании расчетов по химическим реакциям
Определение химического элемента на основании расчетов по химическим реакциям Енергія води та вітру . Як ми її використовуємо в житті.
Енергія води та вітру . Як ми її використовуємо в житті. Подходы к отбору методического материала с учётом дифференцированного обучения на уроках химии. cЛукьянова Анастасия Никола
Подходы к отбору методического материала с учётом дифференцированного обучения на уроках химии. cЛукьянова Анастасия Никола Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Применение этанола
Применение этанола Кальций. Химиялық қасиеті
Кальций. Химиялық қасиеті Оксиды азота
Оксиды азота Хлороводород и соляная кислота. Свойства и применение. Подготовила: Ученица 8 класса МБОУ СОШ с.Фащёвка Столяренко Дарья
Хлороводород и соляная кислота. Свойства и применение. Подготовила: Ученица 8 класса МБОУ СОШ с.Фащёвка Столяренко Дарья  Роботу виконав: Желєзний Влад
Роботу виконав: Желєзний Влад  Спирти. Класифікація спиртів
Спирти. Класифікація спиртів Алюміній
Алюміній  Проект: жило-было мыло
Проект: жило-было мыло Научные принципы химического производства. Производство аммиака
Научные принципы химического производства. Производство аммиака Автометаморфизм
Автометаморфизм Презентация по Химии "Природні І синтетичні Органічні речовини" - скачать смотреть бесплатно
Презентация по Химии "Природні І синтетичні Органічні речовини" - скачать смотреть бесплатно Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук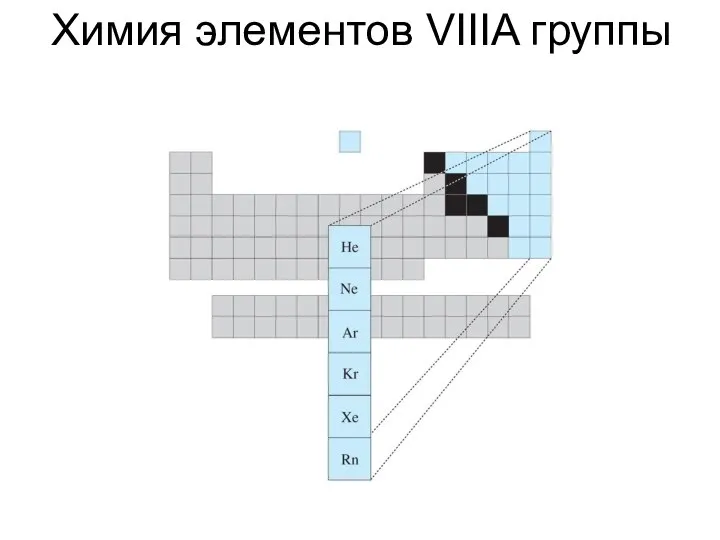 Химия элементов VIIIA группы
Химия элементов VIIIA группы