Содержание
- 2. План лекции 1. Фармацевтическая биоэтика а) Талидомид б) Биоэтика как наука 2. Ключевые вопросы биоэтики 3.
- 3. Актуальность темы Успешная работа по продвижении лекарственных препаратов на рынок много в чем зависит от профессионализма
- 4. Фармацевтическая биоэтика Ускорение научно-технического прогресса во ІІ половине XX в. ярко высветило проблемы морально-нравственных норм и
- 5. Фармацевтическая биоэтика В ответ на сложившуюся ситуацию появилось новое направление в науке - биоэтика. Термин «биоэтика»
- 6. Фармацевтическая биоэтика Биоэтика - наука, изучающая противоречия между интересами людей, а также их сообществ в области
- 7. Фармацевтическая биоэтика Первый круг проблем биомедицинской этики связан с проявлением в деятельности медицинского работника общечеловеческих моральных
- 8. Фармацевтическая биоэтика 1) проблема активного включения в лечебную практику в качестве руководства к действию свода высших
- 9. Фармацевтическая биоэтика Второй круг проблем биомедицинской этики связан со спецификой, развитием и современными достижениями медицины. К
- 10. Фармацевтическая биоэтика - проблема последствий искусственного оплодо-творения и прерывания беременности; - проблема предвидения и предотвращения негативных
- 11. Ключевые вопросы биоэтики Моральные и философские проблемы аборта Ст. 50 Закона Украины «Основы законодательства Украины о
- 12. Ключевые вопросы биоэтики Технология суррогатного материнства запрещена в некоторых странах (Франции, Германия, Австрии, Норвегии, Швеции, Италии),
- 13. Ключевые вопросы биоэтики Некоммерческое суррогатное материнство: - Великобритания (допускается лишь оплата текущих расходов суррогатной матери); -
- 14. Ключевые вопросы биоэтики Правовое урегулирование суррогатного материнства: - семейный кодекс Украины (ст. 39, 123: п. 1-3);
- 15. Ключевые вопросы биоэтики - приказ МЗ Украины «Об утверждении Инструкции о порядке применения вспомогательных репродуктивных технологий»
- 16. Ключевые вопросы биоэтики Приказ Министерства Здравоохранения Украины № 787 от 09 сентября 2013 года «Об утверждении
- 17. Ключевые вопросы биоэтики Нидерланды: в 1984 году Верховный суд страны признал добровольную эвтаназию приемлемой. Бельгия: эвтаназия
- 18. Эвтаназия в Украине Проведение эвтаназии в Украине квалифицируются как убийство, - и рассматриваются в суде по
- 19. Ключевые вопросы биоэтики Ежегодно в трансплантации сердца в Украине нуждается 2 тыс. человек. Не получает его
- 20. Ключевые вопросы биоэтики «О трансплантации органов и других анатомических материалов человеку» ВР Украины Закон от 16.07.1999
- 21. Фармацевтическая биоэтика В 90х годах XX века началось становление фармацевтической биоэтики как одного из направлений биоэтики,
- 22. Фармацевтическая биоэтика Фармацевтическая биоэтика изучает: моральные, правовые, социальные, экологические и юридические проблемы, возникающие при создании, клинических
- 23. Фармацевтическая биоэтика формы оказания фармацевтических научно-консультативных услуг, с целью защиты здоровья населения и отдельных лиц, качества
- 24. Фармацевтическая биоэтика В 1996 году была проведена первая международная конференция "Фармацевтическая биоэтика", в этот год, можно
- 25. Биоэтические аспекты клинических испытаний лекарственных средств В Украине за последние пять лет проведено более 1000 клинических
- 26. Биоэтические аспекты клинических испытаний лекарственных средств Задачи, стоящие перед фармацевтической биоэтикой в Украине: 1. Решение вопроса
- 27. Биоэтические аспекты клинических испытаний лекарственных средств Субъектом испытания в таком виде исследований является здоровый доброволец, и
- 28. Биоэтические аспекты клинических испытаний лекарственных средств Этические комитеты (ЭК) — это независимые организации, в состав которых
- 29. Биоэтические аспекты клинических испытаний лекарственных средств Базовым документом для создания и функционирования национальных этических комитетов (НЭК)
- 30. Биоэтические аспекты клинических испытаний лекарственных средств ХЕЛЬСИНСКАЯ ДЕКЛАРАЦИЯ ВСЕМИРНОЙ АССОЦИАЦИИ ВРАЧЕЙ Рекомендации для врачей по проведению
- 31. Биоэтические аспекты клинических испытаний лекарственных средств Изложенные в Хельсинской декларации принципы являются рекомендательными положениями, но не
- 32. Биоэтические аспекты клинических испытаний лекарственных средств В 1966 г. принята Международная Конвенция гражданских и политических прав
- 33. НАЦИОНАЛЬНОЕ ЗАКОНОДАТЕЛЬСТВО О КЛИНИЧЕСКИХ ИСПЫТАНИЯХ Правовые и этические вопросы при проведении клинических испытаний рассматриваются: - в
- 34. - в «Типовом положении о комиссии по вопросам этики», утвержденном МЗ Украины (приказ № 690 от
- 35. Биоэтические аспекты клинических испытаний лекарственных средств Ст. 7 закона Украины «О лекарственных средствах»: клинические исследования лекарственных
- 36. Биоэтические аспекты клинических испытаний лекарственных средств Ст. 8 закона Украины «О лекарственных средствах»: клинические исследования лекарственных
- 37. Биоэтические аспекты клинических испытаний лекарственных средств Заказчик клинического исследования лекарственного средства обязан составить договор о страховании
- 38. Биоэтические аспекты клинических испытаний лекарственных средств Решение о приостановке клинического испытания лекарственного средства или отдельных его
- 39. Биоэтические аспекты клинических испытаний лекарственных средств В Украине в 1995 г. при Государственном фармакологическом комитете МЗ
- 40. Биоэтические аспекты клинических испытаний лекарственных средств ГФЦ в 2000 г. были разработаны и утверждены МЗ Украины
- 41. ТРЕБОВАНИЯ GCP К ЭК Европейский форум GCP разработал рекомендации относительно состава ЭК. Не менее 5 человек
- 42. ТРЕБОВАНИЯ GCP К ЭК В состав ЭК должны быть включены также - юрист; - парамедик; -
- 43. Основными задачами Комиссии по вопросам этики являются: - защита прав и интересов исследуемых, привлеченных к клиническому
- 44. До начала проведения клинического испытания лекарственного средства ЭК оценивает этические и нравственно-правовые аспекты программы (протокола) клинического
- 45. пригодность исследователя(лей) для проведения предложенного клинического испытания; соответствие исследовательского центра целям и задачам исследования; процедуру привлечения
- 46. Во время проведения клинического испытания лекарственного средства Комиссия осуществляет контроль по защите прав и здоровья исследуемых,
- 47. В процессе проведения клинических испытаний исследователь информирует Комиссию в следующих случаях: при внесении любых изменений и
- 48. В Украине в настоящее время проводится активная работа по созданию местных этических комиссий. Сейчас при лечебно-профилактических
- 49. ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ Согласно существующей в Украине практике, клинические испытания лекарственных средств
- 50. ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ Изучение фармакокинетики оригинальных или сравнительной фармакокинетики генерических лекарств следует
- 51. ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ Прежде чем приступить к исследованию с привлечением детей, рекомендуется
- 52. Не следует привлекать к клиническим исследованиям детей, содержащихся в домах для сирот, исправительных учреждениях, а также
- 54. Скачать презентацию

















































 Гипоксия. Кислородный каскад
Гипоксия. Кислородный каскад Понятие фонетико-фонематическое недоразвитие
Понятие фонетико-фонематическое недоразвитие L’essayage en prothèse fixée plurale dento-portée
L’essayage en prothèse fixée plurale dento-portée Аномалии родовой деятельности
Аномалии родовой деятельности Рак отдельных локализаций (пищевода, желудка, молочной железы, матки)
Рак отдельных локализаций (пищевода, желудка, молочной железы, матки) Қауіп қатерді бағалау әдістемесі негізінде өмір сүру орта сапасын басқарудағы тәсілдірді үйлестіру сұрағына
Қауіп қатерді бағалау әдістемесі негізінде өмір сүру орта сапасын басқарудағы тәсілдірді үйлестіру сұрағына Аттестационная работа. Образовательная программа внеурочной деятельности По тропинкам к здоровью
Аттестационная работа. Образовательная программа внеурочной деятельности По тропинкам к здоровью Патогенез. Определение. Значение
Патогенез. Определение. Значение Альгодисменорея. Симптомы заболевания
Альгодисменорея. Симптомы заболевания Основные причины увеличения смертности в трудоспособном возрасте
Основные причины увеличения смертности в трудоспособном возрасте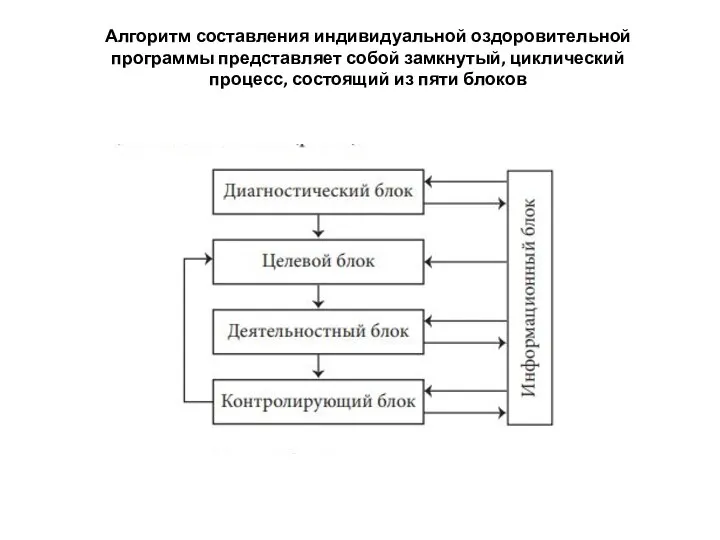 Алгоритм составления индивидуальной оздоровительной программы
Алгоритм составления индивидуальной оздоровительной программы Гастроэзофагеальная рефлюксная болезнь
Гастроэзофагеальная рефлюксная болезнь Гонорея. Гонорея девочек. Вич - инфекция, кожные проявления. Профилактика (лекция № 10)
Гонорея. Гонорея девочек. Вич - инфекция, кожные проявления. Профилактика (лекция № 10) Биохимия минерализованных тканей зуба
Биохимия минерализованных тканей зуба Режимы лечебно-профилактических учреждений
Режимы лечебно-профилактических учреждений Скриниг колоректального рака от массовости к индивидуализации
Скриниг колоректального рака от массовости к индивидуализации Мониторинг лекарственных средств
Мониторинг лекарственных средств Клиническая анатомия мозгового отдела головы. Введение в предмет топографической анатомии и оперативной хирургии
Клиническая анатомия мозгового отдела головы. Введение в предмет топографической анатомии и оперативной хирургии Нәрестелерде ішек жолының бітелуі себептері, патанатомиясы, хирургиялық емдік іс-шаралары
Нәрестелерде ішек жолының бітелуі себептері, патанатомиясы, хирургиялық емдік іс-шаралары Женское бесплодие
Женское бесплодие Формирование правильной осанки
Формирование правильной осанки Акупунктурная коррекция контрактуры мимических мышц
Акупунктурная коррекция контрактуры мимических мышц Крупозная пневмония 2
Крупозная пневмония 2 Организация медицинского обеспечения населения в чрезвычайных ситуациях мирного и военного времени
Организация медицинского обеспечения населения в чрезвычайных ситуациях мирного и военного времени Сервис и пациентоориентированность в клинике: что делать управленцам
Сервис и пациентоориентированность в клинике: что делать управленцам Предмет, история и методы психологии физической культуры. Вощинин Александр Владимирович
Предмет, история и методы психологии физической культуры. Вощинин Александр Владимирович Общая рецептура
Общая рецептура Кишечный шов
Кишечный шов