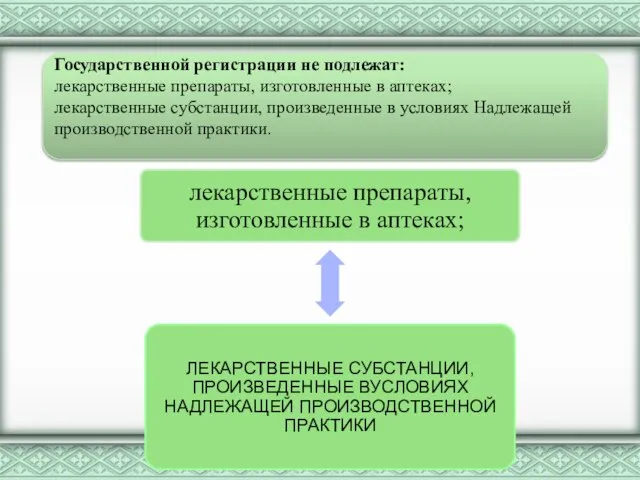
Государственной регистрации и перерегистрации подлежат произведенные в Республике Казахстан, а также
ввозимые на ее территорию лекарственные средства, зарегистрированные в стране-производителе, включая:
лекарственные препараты под торговыми наименованиями с указанием лекарственной формы, дозировки, фасовки;
балк-продукты лекарственных средств, ввозимые в Республику Казахстан;
новые комбинации ранее зарегистрированных в Республике Казахстан лекарственных средств с указанием лекарственной формы, дозировки, фасовки;
лекарственные средства, зарегистрированные ранее в Республике Казахстан, но произведенные другими организациями-производителями в других лекарственных формах с новой дозировкой, новой фасовкой, новой упаковкой, другим составом вспомогательных веществ, другим названием.






 Підходи до лікування та вибору препаратів при лихоманці
Підходи до лікування та вибору препаратів при лихоманці Гигиена учебной деятельности в ДОУ. Требования к режиму помещения (воздушная среда, тепловой режим, водоснабжение и мебель)
Гигиена учебной деятельности в ДОУ. Требования к режиму помещения (воздушная среда, тепловой режим, водоснабжение и мебель) Анемии
Анемии Распространенность ахондроплазии в мире
Распространенность ахондроплазии в мире Скрининг, прогнозирование, диагностика и мониторинг сахарного диабета
Скрининг, прогнозирование, диагностика и мониторинг сахарного диабета Мочевая система
Мочевая система Определение чувствительности бактерий к антибактериальным средствам. Химиотерапия и химиопрофилактика
Определение чувствительности бактерий к антибактериальным средствам. Химиотерапия и химиопрофилактика Конфликты. Формирование стратегии позитивных взаимодействий
Конфликты. Формирование стратегии позитивных взаимодействий Общая психология. Тест по темам: воображение, мышление, речь, внимание
Общая психология. Тест по темам: воображение, мышление, речь, внимание Хирургическая анатомия шеи. Операции на органах шеи
Хирургическая анатомия шеи. Операции на органах шеи Закон притяжения: 12 способов привлечь то, о чем Вы мечтаете
Закон притяжения: 12 способов привлечь то, о чем Вы мечтаете Методы обследования стоматологического больного
Методы обследования стоматологического больного Познавательные процессы. Память. Общая психология. Лекция 3
Познавательные процессы. Память. Общая психология. Лекция 3 Изменения глазного дна при вегето-сосудистой дистонии (ВСД)
Изменения глазного дна при вегето-сосудистой дистонии (ВСД) Клиническая фармакология средств, используемых при спазме бронхиальной мускулатуры
Клиническая фармакология средств, используемых при спазме бронхиальной мускулатуры Пороки развития головного мозга
Пороки развития головного мозга Патология хрусталика у взрослых и детей
Патология хрусталика у взрослых и детей Электрокардиография
Электрокардиография Неалкогольная жировая болезнь печени
Неалкогольная жировая болезнь печени Первоклассник – это ребенок…
Первоклассник – это ребенок… Лебедева Н. 220 группа - Фенилкетонурия
Лебедева Н. 220 группа - Фенилкетонурия Основные признаки нарушения деятельности систем и органов при интоксикации животных
Основные признаки нарушения деятельности систем и органов при интоксикации животных Психотропные средства. Нейролептики и нормотимики
Психотропные средства. Нейролептики и нормотимики Бронхиальная астма
Бронхиальная астма Аномалия Эбштейна
Аномалия Эбштейна Кисты яичников
Кисты яичников Специфика образа жизни людей, практикующих осознанные сновидения
Специфика образа жизни людей, практикующих осознанные сновидения Наследственные семейные гепатозы. Хронические гепатиты у детей
Наследственные семейные гепатозы. Хронические гепатиты у детей