Содержание
- 2. Хромопротеины Хромопротеины (от греч. chroma — краска) — сложные белки, состоящие из простого белка и связанного
- 3. Гемопротеины – сложные белки, в состав простетической группы которых входит ион метила и порфириновое ядро. Виды
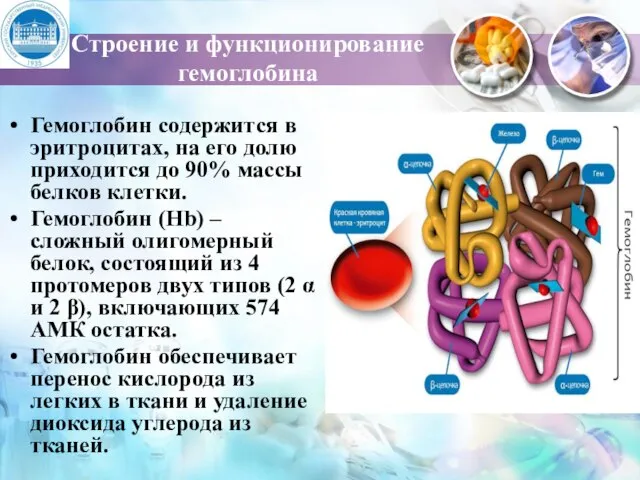
- 4. Строение и функционирование гемоглобина Гемоглобин содержится в эритроцитах, на его долю приходится до 90% массы белков
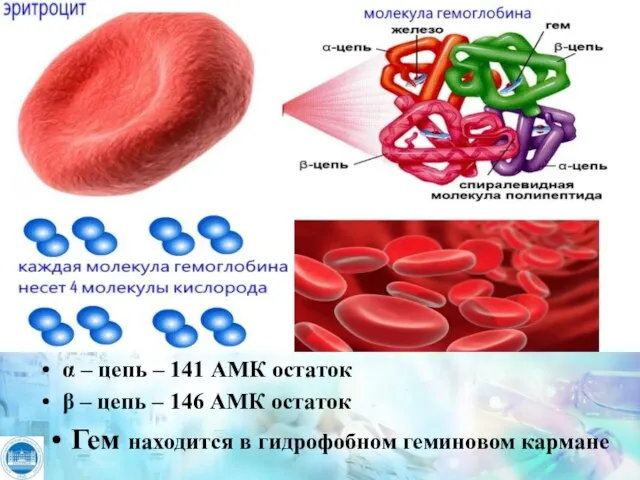
- 5. α – цепь – 141 АМК остаток β – цепь – 146 АМК остаток Гем находится
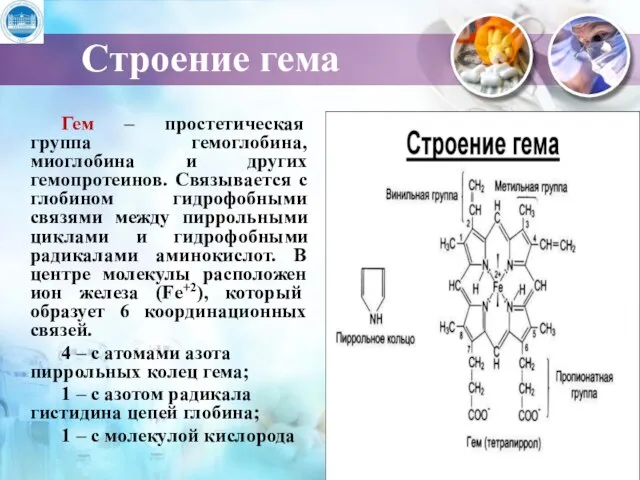
- 6. Строение гема Гем – простетическая группа гемоглобина, миоглобина и других гемопротеинов. Связывается с глобином гидрофобными связями
- 7. Миоглобин Миоглобин (Мб) – осуществляет внутриклеточный транспорт и кратковременное депонирование кислорода в мышцах. Миоглобин не является
- 8. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2 (активные центры). Молекула миоглобина
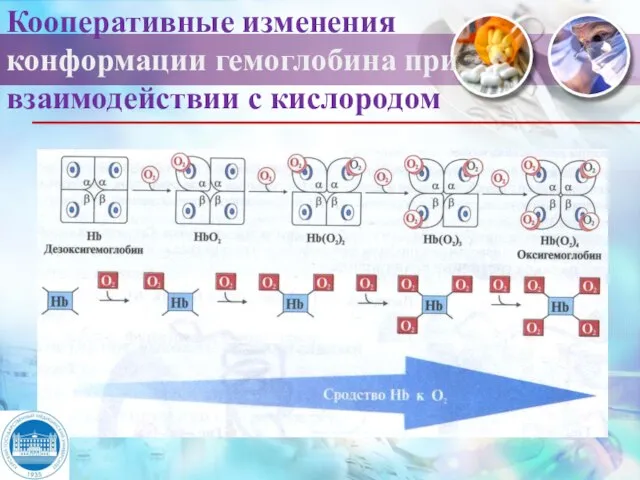
- 9. Кооперативные изменения конформации гемоглобина при взаимодействии с кислородом
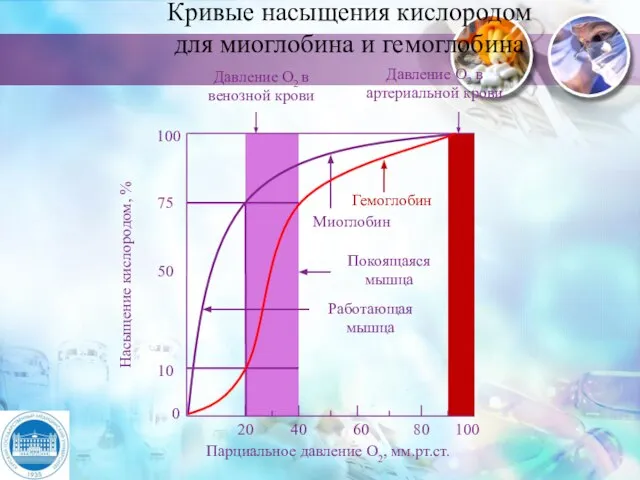
- 10. Кривые насыщения кислородом для миоглобина и гемоглобина Давление О2 в венозной крови Давление О2 в артериальной
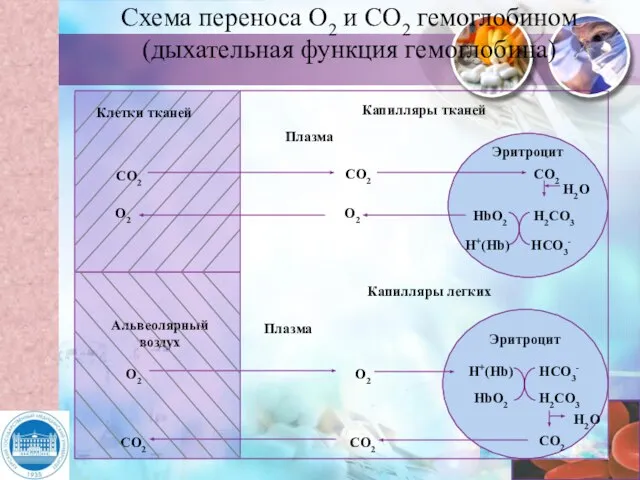
- 11. Капилляры тканей Капилляры легких Плазма Плазма СО2 О2 О2 СО2 СО2 Н2О Н2СО3 НСО3- HbО2 H+(Hb)
- 13. Эффект Бора Hb не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт
- 14. Эффект Холдейна Эффект Холдейна можно объяснить следующим образом. Присоединение кислорода в легких к гемоглобину превращает гемоглобин
- 15. Появление физиологических типов гемоглобина в онтогенезе Примитивный – HbP ε4 Эмбриональный – HbU α2 ε2 синтезируется
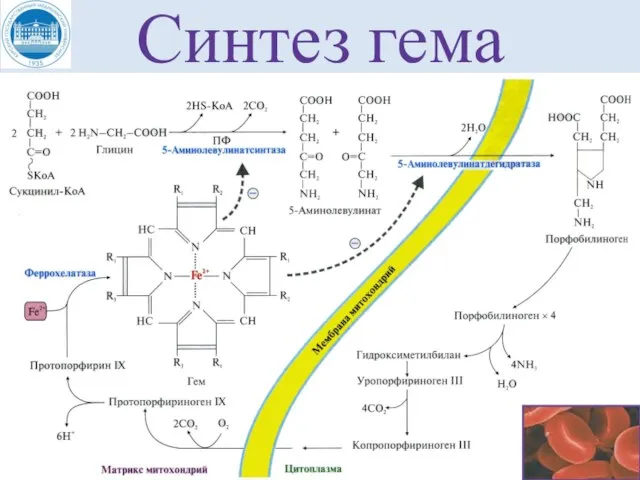
- 16. Синтез гема
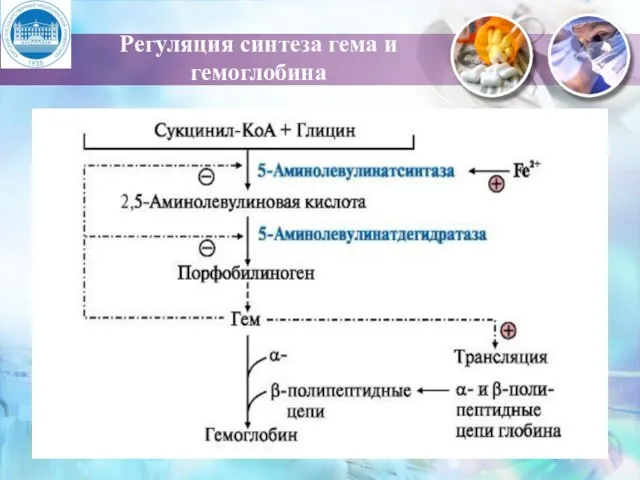
- 17. Регуляция синтеза гема и гемоглобина
- 18. Нарушение синтеза гемоглобина Гемоглобинопатии – аномалии связанные с нарушением механизма синтеза белкового компонента гемоглобина, при нормальной
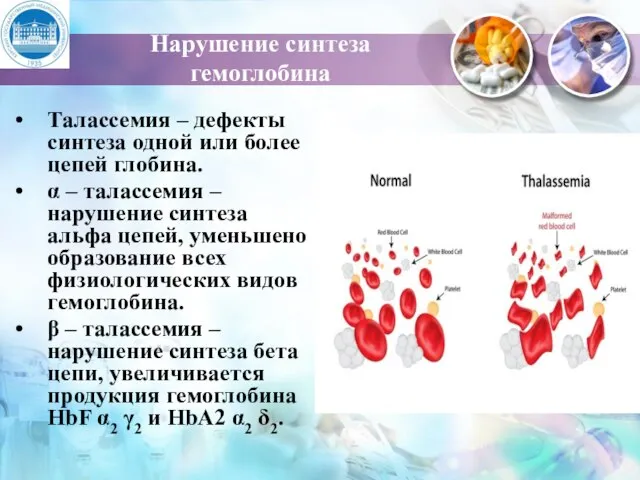
- 19. Нарушение синтеза гемоглобина Талассемия – дефекты синтеза одной или более цепей глобина. α – талассемия –
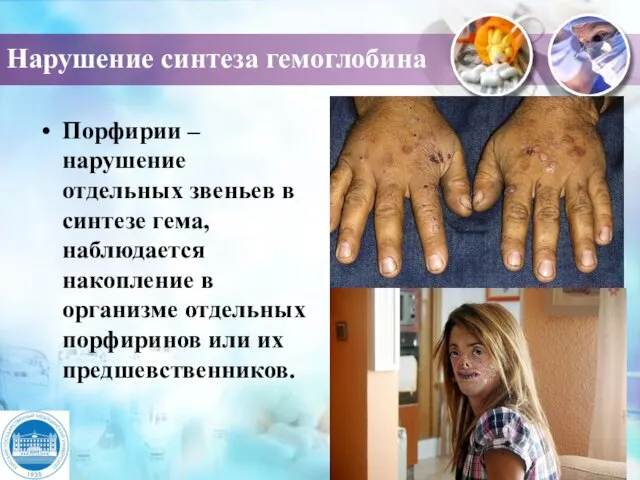
- 20. Нарушение синтеза гемоглобина Порфирии – нарушение отдельных звеньев в синтезе гема, наблюдается накопление в организме отдельных
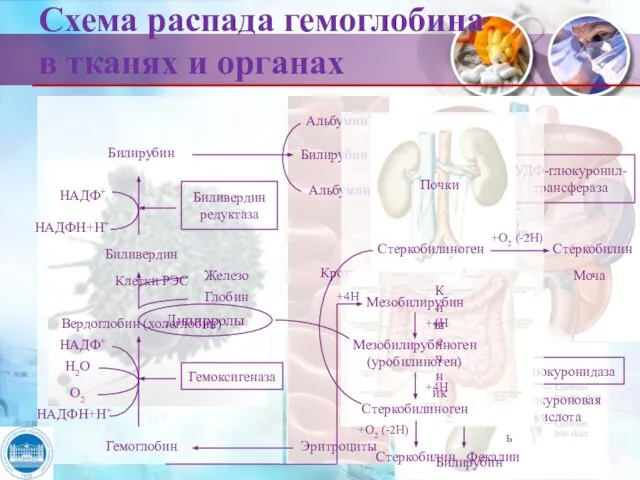
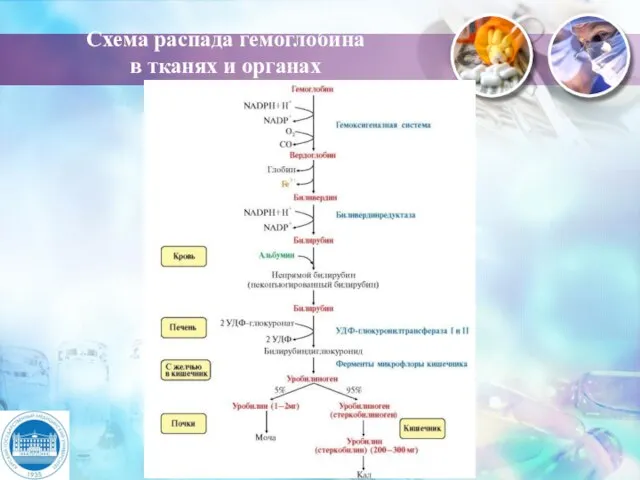
- 21. Схема распада гемоглобина в тканях и органах Клетки РЭС Билирубин Биливердин Вердоглобин (холеглобин) Гемоглобин НАДФ+ НАДФН+Н+
- 22. Схема распада гемоглобина в тканях и органах
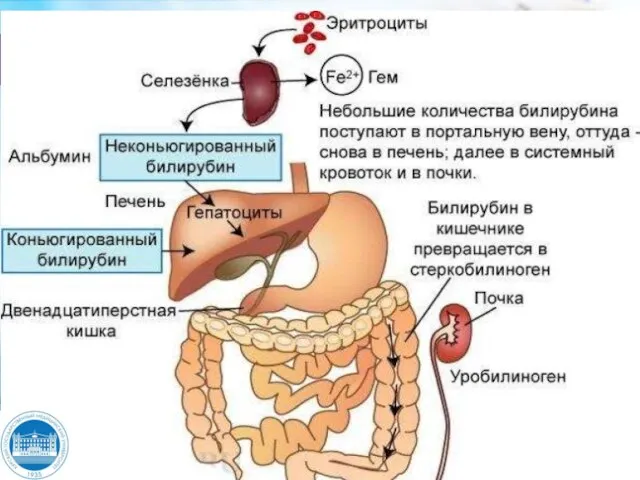
- 24. Билирубин Билирубин – тетрапирральный пигмент, молекулярная формула С33Н56N4О6, молекулярная масса – 584 Д. Билирубин – неполярная
- 25. Клиническое значение гипербилирубинемии Норма – общий билирубин в сыворотке не превышает 25,7 мкмоль/л, среднее значение 12
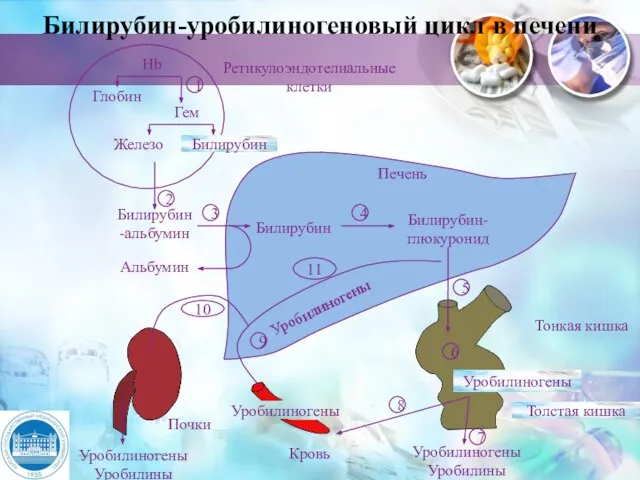
- 26. Билирубин-уробилиногеновый цикл в печени
- 27. Желтуха Желтуха (болезнь Госпела) (лат. icterus) — желтушное окрашивание кожи и видимых слизистых оболочек, обусловленное повышенным
- 28. Типы и причины желтух чрезмерного разрушения эритроцитов и повышенной выработки билирубина — гемолитическая или надпечёночная желтуха;
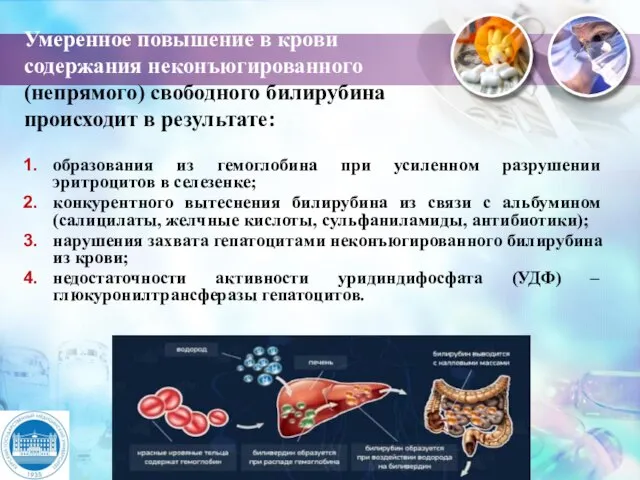
- 30. Умеренное повышение в крови содержания неконъюгированного (непрямого) свободного билирубина происходит в результате: образования из гемоглобина при
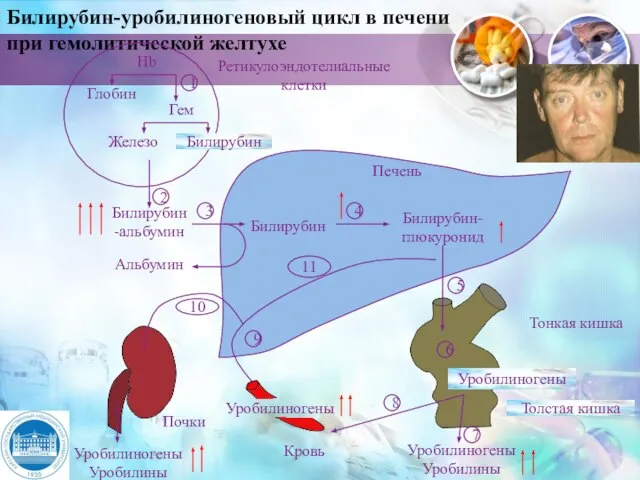
- 31. Билирубин-уробилиногеновый цикл в печени при гемолитической желтухе Ретикулоэндотелиальные клетки Печень Тонкая кишка Толстая кишка Уробилиногены Уробилины
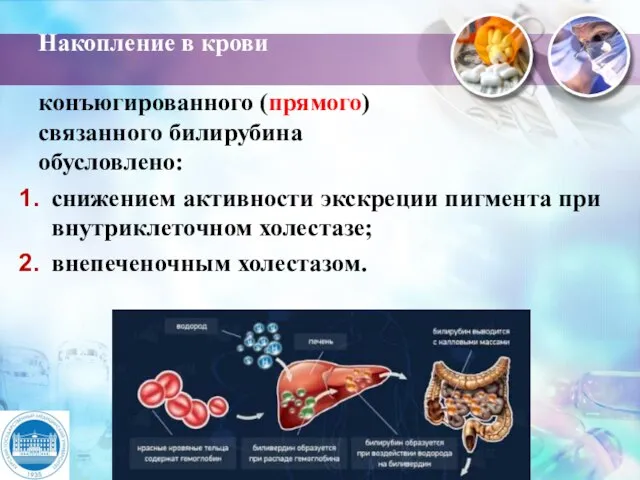
- 32. Накопление в крови конъюгированного (прямого) связанного билирубина обусловлено: снижением активности экскреции пигмента при внутриклеточном холестазе; внепеченочным
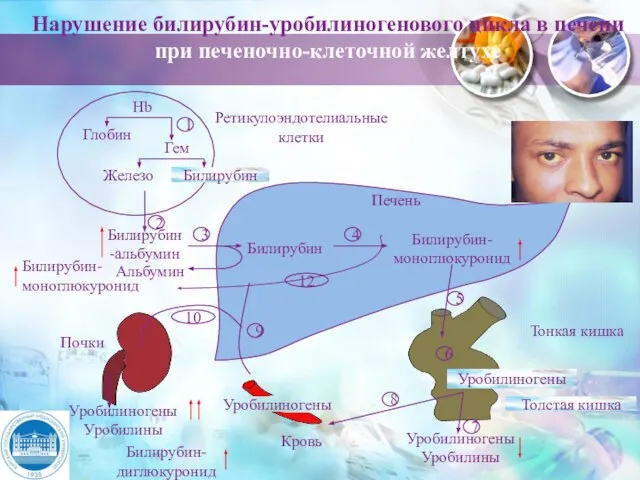
- 33. Нарушение билирубин-уробилиногенового цикла в печени при печеночно-клеточной желтухе
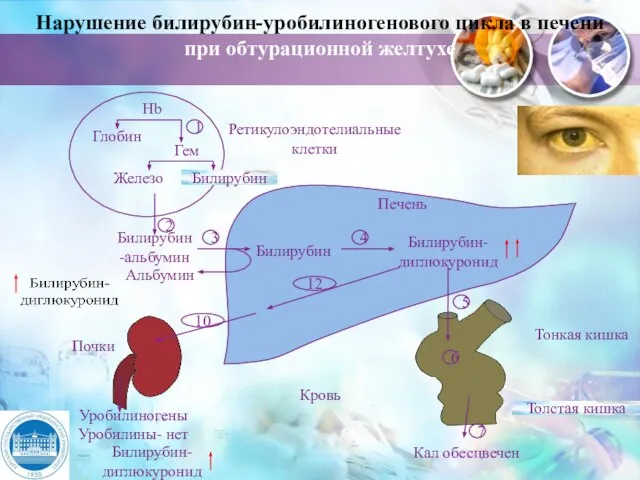
- 34. Нарушение билирубин-уробилиногенового цикла в печени при обтурационной желтухе
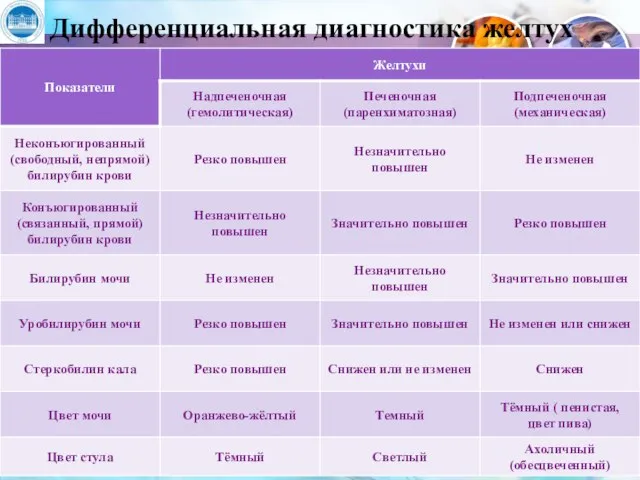
- 35. Дифференциальная диагностика желтух
- 37. Скачать презентацию













 Методы исследования в возрастной физиологии
Методы исследования в возрастной физиологии Транзактный анализ Э. Берна
Транзактный анализ Э. Берна Медицина в Канаде
Медицина в Канаде Микробиологическая диагностика инфекционных заболеваний. Микроскопический метод
Микробиологическая диагностика инфекционных заболеваний. Микроскопический метод Зачам мыть руки
Зачам мыть руки Консультация по проведению ГИА в педиатрии. Порядок оказания медицинской помощи
Консультация по проведению ГИА в педиатрии. Порядок оказания медицинской помощи Рентгенологические синдромы опорно - двигательного аппарата (ОДА)
Рентгенологические синдромы опорно - двигательного аппарата (ОДА) Липиды (от греческого lipos – жир) – неоднородная группа гидрофобных органических соединений биологической природы
Липиды (от греческого lipos – жир) – неоднородная группа гидрофобных органических соединений биологической природы Развитие общения, как важнейший фактор психического развития детей
Развитие общения, как важнейший фактор психического развития детей Универсальный алгоритм оказания первой помощи
Универсальный алгоритм оказания первой помощи Бронхиальная астма у детей
Бронхиальная астма у детей Финансирование стационарной помощи, ПМСП. СКПН
Финансирование стационарной помощи, ПМСП. СКПН Қазіргі қоғамдағы аномальды балаларға деген көзқарас
Қазіргі қоғамдағы аномальды балаларға деген көзқарас Стафилококки. Стрептококки
Стафилококки. Стрептококки Неонатальный сепсис
Неонатальный сепсис Дерматиты, экзема, токсикодермии. Профессиональные дерматозы. Нейродерматозы
Дерматиты, экзема, токсикодермии. Профессиональные дерматозы. Нейродерматозы Терминальные состояния. Клиническая смерть. Основные и специализированные приемы сердечно-легочной реанимации
Терминальные состояния. Клиническая смерть. Основные и специализированные приемы сердечно-легочной реанимации Здоровое питание
Здоровое питание Амбулаторные экспертизы
Амбулаторные экспертизы Қоршаған орта факторларының салдарлық итж дамуындағы маңызы
Қоршаған орта факторларының салдарлық итж дамуындағы маңызы Инфекционный мононуклеоз
Инфекционный мононуклеоз Диабеттік ретинопатия
Диабеттік ретинопатия РАС - расстройства аутистического спектра
РАС - расстройства аутистического спектра Гострий діарейний синдром. Холера
Гострий діарейний синдром. Холера Клеточный, гуморальный иммунитет и их роль в защите от инфекций
Клеточный, гуморальный иммунитет и их роль в защите от инфекций Виды мутаций
Виды мутаций Характеристика бета-адреноблокаторов. Альфа-1-адренергические блокаторы
Характеристика бета-адреноблокаторов. Альфа-1-адренергические блокаторы Обмен сложных белков – нуклеопротеинов и хромопротеинов
Обмен сложных белков – нуклеопротеинов и хромопротеинов