Содержание
- 2. Содержание презентации: Введение История создания препарата Торговое описание препарата Физико-химическая характеристика препарата Характеристика CD20-АГ Фармакология Показания
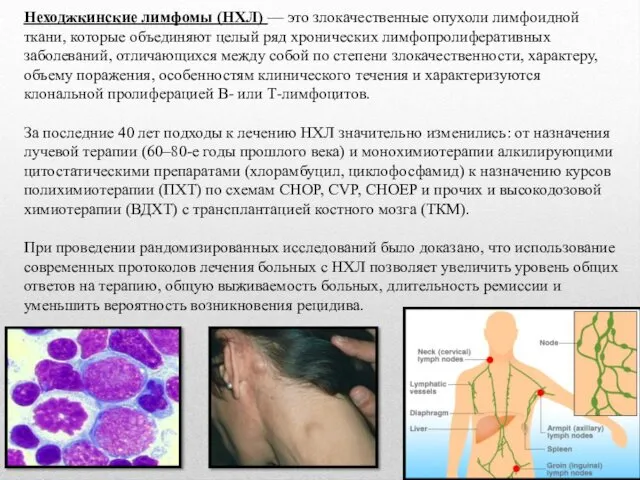
- 3. Неходжкинские лимфомы (НХЛ) — это злокачественные опухоли лимфоидной ткани, которые объединяют целый ряд хронических лимфопролиферативных заболеваний,
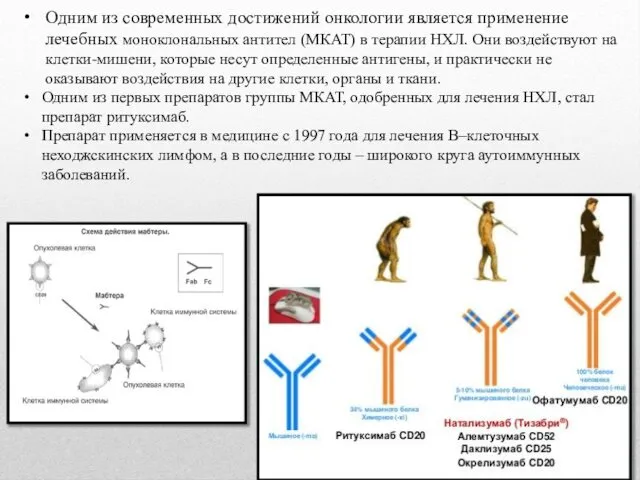
- 4. Одним из современных достижений онкологии является применение лечебных моноклональных антител (МКАТ) в терапии НХЛ. Они воздействуют
- 5. Ритуксимаб был разработан IDEC Pharmaceuticals под названием IDEC-С2В8. Патент США был выдан в 1998 году. На
- 7. Ритуксимаб (торговые названия Ритуксан, Мабтера и Zytux) представляет собой химерное моноклональное антитело против белка CD20, который
- 8. Прозрачная или слегка опалесцирующая, бесцветная или светло-желтого цвета жидкость. Применение: внутривенное вливание, подкожное введение (с 2014
- 9. Химерные антитела вырабатываются культурой суспензии клеток млекопитающих (яичниками китайского хомяка) и очищаются с помощью аффинной хроматографии
- 10. CD20 — поверхностный антиген, который экспрессируется более чем на 90% лимфоцитов, не исчезает и не трансформируется
- 11. Выбор CD20 молекулы в качестве мишени для моноклональных антител связан с особенностями дифференцировки В–клеток, которые в
- 12. Фармакология (фармакологическое действие – противоопухолевое). Fab-фрагмент ритуксимаба связывается с CD20-антигеном на лимфоцитах. CD20 широко экспрессируется на
- 13. Ритуксимаб связывается с лимфоидными клетками тимуса, белой пульпы селезенки и большинством В-лимфоцитов периферической крови и лимфатических
- 14. Неходжкинская лимфома: — рецидивирующая или химиоустойчивая В-клеточная, CD20-положительная неходжкинская лимфома низкой степени злокачественности или фолликулярная; —
- 15. Ревматоидный артрит: — среднетяжелый и тяжелый ревматоидный артрит (активная форма) у взрослых в комбинации с метотрексатом
- 16. Побочные действия препарата Фатальные инфузионные реакции. Имеются сообщения о летальных исходах в течение 24 ч после
- 17. Реакции со стороны слизистых оболочек и кожи . Эти реакции включают паранеопластическую, синдром Стивенса-Джонсона, лихеноидный дерматит,
- 18. Сердечно-сосудистые нежелательные явления. Сердечно-сосудистые реакции 3-й и 4-й степени тяжести включают гипотензию. Описаны редкие, фатальные случаи
- 19. гиперчувствительность к ритуксимабу, любому компоненту препарата или белкам мыши; острые инфекционные заболевания; выраженный первичный или вторичный
- 20. Необходимое количество препарата набирают в асептических условиях и разводят до расчетной концентрации (1-4 мг/мл) в инфузионном
- 21. Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол; антигистаминный препарат, например, дифенгидрамин). Если
- 22. Повторное применение в случае рецидива (у пациентов, ответивших на первый курс терапии): 375 мг/м2 1 раз
- 23. Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол; антигистаминный препарат, например, дифенгидрамин). Если
- 24. Клинические исследования В исследования были включены больные (N=296) c рецидивирующей или резистентной к терапии B-клеточной неходжкинской
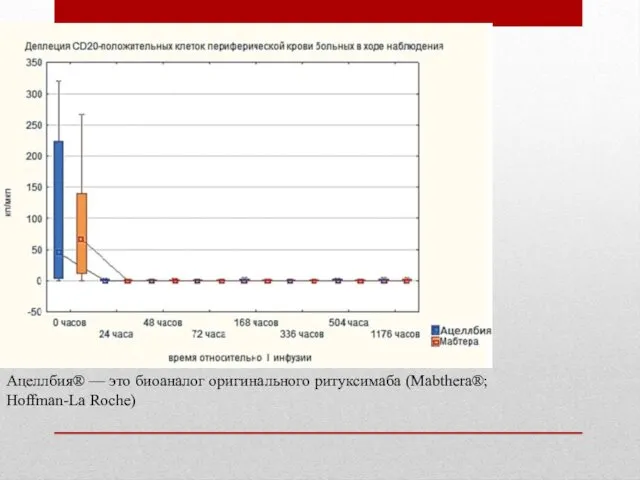
- 25. Ацеллбия® — это биоаналог оригинального ритуксимаба (Mabthera®; Hoffman-La Roche)
- 27. Спасибо за внимание !
- 28. https://druginfo.nlm.nih.gov/drugportal/name/Rituximab https://toxnet.nlm.nih.gov/ https://www.ncbi.nlm.nih.gov/ https://www.pubmedhealth/
- 29. Что делает Ритуксимаб? (пенсильвания) Это моноклональное антитело против молекулы CD20, расположенной на мембране В-лимфоцитов. Ритуксимаб связывается
- 30. Исследователи взяли цитотоксический Т-лимфоцит и создали конструкцию CAR-T, в которой внешняя часть бывшего Т-клеточного рецептора была
- 31. Персонализированная терапия излечила рак крови у мышей Американские ученые разработали новый метод прицельной персонализированной терапии В-клеточных
- 32. В ходе эксперимента in vitro пептидные антитела в течение 24 часов активировали в опухолевых клетках фермент
- 34. Скачать презентацию
Содержание презентации:
Введение
История создания препарата
Торговое описание препарата
Физико-химическая характеристика препарата
Характеристика CD20-АГ
Фармакология
Показания к применению
Противопоказания
Содержание презентации:
Введение
История создания препарата
Торговое описание препарата
Физико-химическая характеристика препарата
Характеристика CD20-АГ
Фармакология
Показания к применению
Противопоказания
Побочное действие препарата
Правила приготовления и хранения раствора
Стандартный режим дозирования
Неходжкинские лимфомы (НХЛ) — это злокачественные опухоли лимфоидной ткани, которые объединяют
Неходжкинские лимфомы (НХЛ) — это злокачественные опухоли лимфоидной ткани, которые объединяют
За последние 40 лет подходы к лечению НХЛ значительно изменились: от назначения лучевой терапии (60–80-е годы прошлого века) и монохимиотерапии алкилирующими цитостатическими препаратами (хлорамбуцил, циклофосфамид) к назначению курсов полихимиотерапии (ПХТ) по схемам CHOP, CVP, СНОЕР и прочих и высокодозовой химиотерапии (ВДХТ) с трансплантацией костного мозга (ТКМ).
При проведении рандомизированных исследований было доказано, что использование современных протоколов лечения больных с НХЛ позволяет увеличить уровень общих ответов на терапию, общую выживаемость больных, длительность ремиссии и уменьшить вероятность возникновения рецидива.
Одним из современных достижений онкологии является применение лечебных моноклональных антител (МКАТ)
Одним из современных достижений онкологии является применение лечебных моноклональных антител (МКАТ)
Одним из первых препаратов группы МКАТ, одобренных для лечения НХЛ, стал препарат ритуксимаб.
Препарат применяется в медицине с 1997 года для лечения В–клеточных неходжскинских лимфом, а в последние годы – широкого круга аутоиммунных заболеваний.
Ритуксимаб был разработан IDEC Pharmaceuticals под названием IDEC-С2В8.
Патент США был
Патент США был
Ритуксимаб в сочетании с химиотерапией CHOP (циклофосфамид, гидроксидаунорубицин, онковин, винкристин, преднизолон), превосходит CHOP в лечении диффузной лимфомы В-клеток и многих других В-клеточных лимфом.
В 2010 году препарат был одобрен Европейской Комиссией для поддерживающего лечения после первоначального лечения фолликулярной лимфомы.
Ритуксимаб в настоящее время совместно выпускается на рынок компаниями Biogen Idec и Genentech в США, Hoffmann-La Roche в Канаде и Европейском союзе, Chugai Pharmaceuticals, Zenyaku Kogyo в Японии и AryoGen в Иране.
История создания препарата
Ритуксимаб (торговые названия Ритуксан, Мабтера и Zytux) представляет собой химерное моноклональное
Ритуксимаб (торговые названия Ритуксан, Мабтера и Zytux) представляет собой химерное моноклональное
Ритуксимаб разрушает В-клетки и поэтому используется для лечения заболеваний, которые характеризуются избыточным количеством В-клеток, гиперактивных В-клеток, или дисфункциональных В-клеток, в том числе лимфомы, лейкозы, отторжения трансплантата и аутоиммунные расстройства.
Ритуксимаб-Rituximabum (род. Rituximabi)
Фармакологическая группа: Противоопухолевый иммуномодулирующий препарат. Моноклональные антитела
Прозрачная или слегка опалесцирующая, бесцветная или светло-желтого цвета жидкость.
Применение: внутривенное
Прозрачная или слегка опалесцирующая, бесцветная или светло-желтого цвета жидкость.
Применение: внутривенное
Биодоступность 100% (внутривенно)
Период полураспада: от 30 до 400 часов (в зависимости от дозы и продолжительности лечения)
Экскреция: неопределенная: может пройти фагоцитоз и катаболизм в ретикулоэндотелиальной системе
Торговое описание препарата
Химерные антитела вырабатываются культурой суспензии клеток млекопитающих (яичниками китайского хомяка) и очищаются
По структуре ритуксимаб относится к иммуноглобулинам класса G1 (IgG1 каппа), его молекула содержит мышиные вариабельные фрагменты легких и тяжелых цепей и человеческий постоянный сегмент.
Ритуксимаб состоит из 2 тяжелых цепей из 451 аминокислот и 2 легких цепей из 213 аминокислот и имеет молекулярную массу примерно 145 кД.
Ритуксимаб имеет специфичность к CD20 антигену. Аффинность ритуксимаба к CD20 антигену примерно 8 нМ.
Физико-химическая характеристика препарата
CD20 — поверхностный антиген, который экспрессируется более чем на 90% лимфоцитов,
CD20 — поверхностный антиген, который экспрессируется более чем на 90% лимфоцитов,
Этот антиген является негликозилированным мембранным белком В-лимфоцитов с молекулярной массой 35 кДа, участвующим во внутриклеточной передаче сигнала, дифференцировании В-лимфоцитов и мобилизации кальциевых каналов.
Этот антиген появляется как ранний маркер дифференцирования В-клеточной линии и экспрессируется с разной антигенной плотностью как на нормальных, так и на злокачественных популяциях В-лимфоцитов.
Антитела против CD20-антигена были получены для применения как в исследовательской работе, так и в практике терапии В-клеточных лимфом.
Характеристика CD20-АГ
Выбор CD20 молекулы в качестве мишени для моноклональных антител связан с
Выбор CD20 молекулы в качестве мишени для моноклональных антител связан с
Кроме того, CD20 не высвобождается с мембраны В–лимфоцитов в кровяное русло и поэтому не блокирует взаимодействие ритуксимаба с В–клетками, что увеличивает эффективность терапии.
Полагают, что способность ритуксимаба элиминировать В–клетки реализуется за счет нескольких механизмов, в том числе комплемент–зависимой и антитело–зависимой клеточной цитотоксичности, а также индукции апоптоза
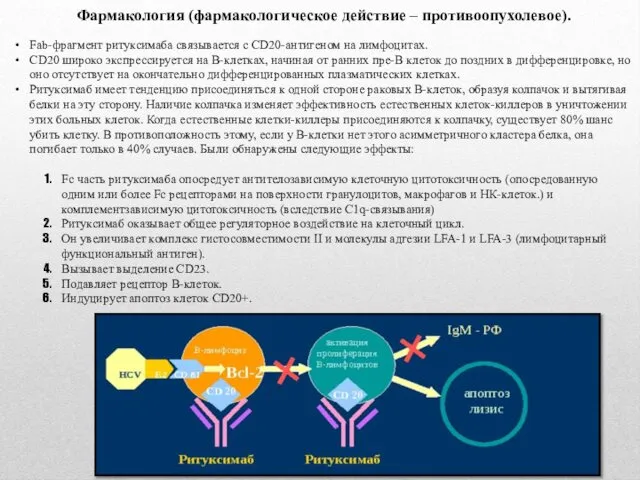
Фармакология (фармакологическое действие – противоопухолевое).
Fab-фрагмент ритуксимаба связывается с CD20-антигеном на лимфоцитах.
CD20
Фармакология (фармакологическое действие – противоопухолевое).
Fab-фрагмент ритуксимаба связывается с CD20-антигеном на лимфоцитах.
CD20
Ритуксимаб имеет тенденцию присоединяться к одной стороне раковых В-клеток, образуя колпачок и вытягивая белки на эту сторону. Наличие колпачка изменяет эффективность естественных клеток-киллеров в уничтожении этих больных клеток. Когда естественные клетки-киллеры присоединяются к колпачку, существует 80% шанс убить клетку. В противоположность этому, если у В-клетки нет этого асимметричного кластера белка, она погибает только в 40% случаев. Были обнаружены следующие эффекты:
Fc часть ритуксимаба опосредует антителозависимую клеточную цитотоксичность (опосредованную одним или более Fc рецепторами на поверхности гранулоцитов, макрофагов и НК-клеток.) и комплементзависимую цитотоксичность (вследствие C1q-связывания)
Ритуксимаб оказывает общее регуляторное воздействие на клеточный цикл.
Он увеличивает комплекс гистосовместимости II и молекулы адгезии LFA-1 и LFA-3 (лимфоцитарный функциональный антиген).
Вызывает выделение CD23.
Подавляет рецептор В-клеток.
Индуцирует апоптоз клеток CD20+.
Ритуксимаб связывается с лимфоидными клетками тимуса, белой пульпы селезенки и большинством
Ритуксимаб связывается с лимфоидными клетками тимуса, белой пульпы селезенки и большинством
Медиана числа B-клеток в периферической крови после первого введения ритуксимаба снижается до уровня ниже нормы, а через 6–9 мес начинает восстанавливаться, возвращаясь к норме к 12 мес после завершения терапии.
Неходжкинская лимфома:
— рецидивирующая или химиоустойчивая В-клеточная, CD20-положительная неходжкинская лимфома низкой степени
Неходжкинская лимфома:
— рецидивирующая или химиоустойчивая В-клеточная, CD20-положительная неходжкинская лимфома низкой степени
— фолликулярная лимфома III-IV стадии в комбинации с химиотерапией у ранее нелеченных пациентов;
— фолликулярная лимфома в качестве поддерживающей терапии после ответа на индукционную терапию;
— CD20-положительная диффузная В-крупноклеточная неходжкинская лимфома в комбинации с химиотерапией по схеме CHOP.
Хронический лимфолейкоз:
— хронический лимфолейкоз в комбинации с химиотерапией у пациентов, ранее не получавших стандартную терапию;
— рецидивирующий или химиоустойчивый хронический лимфолейкоз в комбинации с химиотерапией.
Показания к применению препарата
Ревматоидный артрит:
— среднетяжелый и тяжелый ревматоидный артрит (активная форма) у взрослых
Ревматоидный артрит:
— среднетяжелый и тяжелый ревматоидный артрит (активная форма) у взрослых
Гранулематоз с полиангиитом (гранулематоз Вегенера) и микроскопический полиангиит
— тяжелые формы активного гранулематоза с полиангиитом (гранулематоза Вегенера) и микроскопического полиангиита в комбинации с ГКС.
Число В-клеток в периферической крови после первого введения препарата снижается ниже нормы и начинает восстанавливаться у пациентов с гематологическими злокачественными заболеваниями через 6 месяцев, достигая нормальных значений через 9-12 месяцев после завершения терапии.
Побочные действия препарата
Фатальные инфузионные реакции. Имеются сообщения о летальных исходах в
Побочные действия препарата
Фатальные инфузионные реакции. Имеются сообщения о летальных исходах в
Инфузионные реакции. У большинства в ходе первой инфузии в пределах 30–120 мин., исчезают после замедления или прерывания введения препарата и проведения поддерживающих мероприятий в т.ч. в/в введений физиологического раствора, дифенгидрамина и парацетамола: лихорадка и озноб/дрожь, тошнота, зуд, ангионевротический отек, астения, гипотензия, головная боль, бронхоспазм, раздражение в горле, ринит, крапивница, сыпь, рвота, миалгия, головокружение, гипертензия.
Инфекционные осложнения. Истощению пула B-клеток и уменьшению уровней иммуноглобулинов в сыворотке.
Реакции со стороны слизистых оболочек и кожи . Эти реакции включают
Реакции со стороны слизистых оболочек и кожи . Эти реакции включают
Осложнения со стороны почек. Введение ритуксимаба иногда сопровождалось тяжелой почечной токсичностью, включая ОПН. Частота развития почечной токсичности была выше у больных с большим числом циркулирующих злокачественных лимфоцитов и при высокой опухолевой нагрузке, а также у пациентов, которым при проведении клинических испытаний одновременно назначали цисплатин.
Синдром лизиса опухоли. Ритуксимаб вызывает быстрый лизис доброкачественных и злокачественных CD20-положительных клеток. Описано появление симптомов, характерных для синдрома лизиса опухоли (острая почечная недостаточность, гиперкалиемия, гипокальциемия, гиперурикемия, гиперфосфатемия), в течение 12–24 ч после первой инфузии ритуксимаба.
Сердечно-сосудистые нежелательные явления. Сердечно-сосудистые реакции 3-й и 4-й степени тяжести включают
Сердечно-сосудистые нежелательные явления. Сердечно-сосудистые реакции 3-й и 4-й степени тяжести включают
Легочная симптоматика. Усиление кашля, ринит, бронхоспазм, диспноэ, синусит.
Реактивация гепатита В. Сообщалось о реактивации вируса гепатита В с развитием фульминантного гепатита, печеночной недостаточности и смерти у нескольких пациентов с гематологической злокачественностью, получавших терапию ритуксимабом.
Иммунные/аутоиммунные нежелательные реакции. Сообщалось о таких реакциях, как увеит, зрительный неврит у пациентов с системным васкулитом, плеврит у пациентов с волчаночноподобным синдромом, сывороточная болезнь с полиартикулярным артритом и васкулит с сыпью.
Менее общие наблюдавшиеся побочные эффекты (1-5 %). Ажитация, анорексия, артрит, конъюнктивит, депрессия, диспепсия, эдема, гиперкинезия, гипертензия, гипестезия, гипогликемия, боль в месте инъекции, инсомния, нарушение слезоотделения, недомогание, раздражительность, неврит, нейропатия, парестезия, сонливость, вертиго, понижение массы тела.
гиперчувствительность к ритуксимабу, любому компоненту препарата или белкам мыши;
острые инфекционные заболевания;
выраженный
гиперчувствительность к ритуксимабу, любому компоненту препарата или белкам мыши;
острые инфекционные заболевания;
выраженный
тяжелая сердечная недостаточность (IV класс по классификации NYHA) при ревматоидном артрите;
детский и подростковый возраст до 18 лет (эффективность и безопасность не установлены);
беременность;
период грудного вскармливания;
Противопоказания к применению препарата
Ограничения к применению:
Высокая опухолевая нагрузка (размеры очагов более 10 см), опухолевая инфильтрация легких, легочная недостаточность в анамнезе, сердечно-сосудистые заболевания (стенокардия, аритмия), нейтропения (менее 1500 клеток/мкл), тромбоцитопения (менее 75000 клеток/мкл), детский возраст (безопасность и эффективность применения у детей не установлены).
Необходимое количество препарата набирают в асептических условиях и разводят до расчетной
Необходимое количество препарата набирают в асептических условиях и разводят до расчетной
Т.к. препарат не содержит консервантов, приготовленный раствор необходимо использовать немедленно.
Приготовленный инфузионный раствор физически и химически стабилен в течение 12 ч при комнатной температуре или в течение не более 24 ч при температуре от 2° до 8°С.
Препарат вводят только в/в капельно, через отдельный катетер! Вводить препарат в/в струйно или болюсно нельзя!
Рекомендуемая начальная скорость первой инфузии 50 мг/ч, в дальнейшем ее можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч.
Последующие инфузии можно начинать со скорости 100 мг/ч и увеличивать ее на 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч.
Коррекция дозы в ходе терапии
Снижать дозу ритуксимаба не рекомендуется. Если препарат вводится в комбинации с химиотерапией, снижение дозы химиотерапевтических препаратов проводят в соответствии со стандартными рекомендациями.
Правила приготовления и хранения раствора
Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол;
Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол;
Если Мабтера применяется не в комбинации с химиотерапией, содержащей ГКС, то в состав премедикации также входят ГКС.
Первоначальная терапия:
Монотерапия взрослых больных: 375 мг/м2 1 раз в неделю, в течение 4 недель.
В комбинации с химиотерапией по любой схеме: 375 мг/м2 в первый день цикла химиотерапии после в/в введения ГКС в качестве компонента терапии, в течение:
— 8 циклов (цикл: 21 день) при схеме R-CVP (ритуксимаб, циклофосфамид, винкристин, преднизолон);
— 8 циклов (цикл: 28 дней) при схеме R-MCP (ритуксимаб, митоксантрон, хлорамбуцил, преднизолон);
— 8 циклов (цикл: 21 день) при схеме R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин, преднизолон); в случае достижения полной ремиссии после 4 цикла возможно ограничиться 6 циклами;
— 6 циклов (цикл: 21 день) при схеме R-CHVP-Interferon (ритуксимаб, циклофосфамид, доксорубицин, тенипозид, преднизолон+интерферон).
Стандартный режим дозирования
Неходжкинская лимфома низкой степени злокачественности или фолликулярная
Повторное применение в случае рецидива (у пациентов, ответивших на первый курс
Повторное применение в случае рецидива (у пациентов, ответивших на первый курс
Поддерживающая терапия (после ответа на индукционную терапию):
— у ранее нелеченных пациентов: 375 мг/м2 1 раз в 2 месяца, не более 2 лет (12 инфузий). При появлении признаков прогрессирования заболевания терапию препаратом Мабтера следует прекратить;
— при рецидивирующей или химиоустойчивой лимфоме: 375 мг/м2 1 раз в 3 месяца, не более 2 лет. При появлении признаков прогрессирования заболевания терапию препаратом Мабтера следует прекратить.
Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол;
Перед каждой инфузией препарата Мабтера необходимо проводить премедикацию (анальгетик/антипиретик, например, парацетамол;
Если Мабтера применяется не в комбинации с химиотерапией, содержащей ГКС, то в состав премедикации также входят ГКС.
В комбинации с химиотерапией по схеме CHOP: 375 мг/м2 в первый день каждого цикла химиотерапии после в/в введения ГКС, 8 циклов.
Другие компоненты схемы CHOP (циклофосфамид, доксорубицин и винкристин) вводят после назначения препарата Мабтера.
Диффузная В-крупноклеточная неходжкинская лимфома
Стандартный режим дозирования
Клинические исследования
В исследования были включены больные (N=296) c рецидивирующей или резистентной
Клинические исследования
В исследования были включены больные (N=296) c рецидивирующей или резистентной
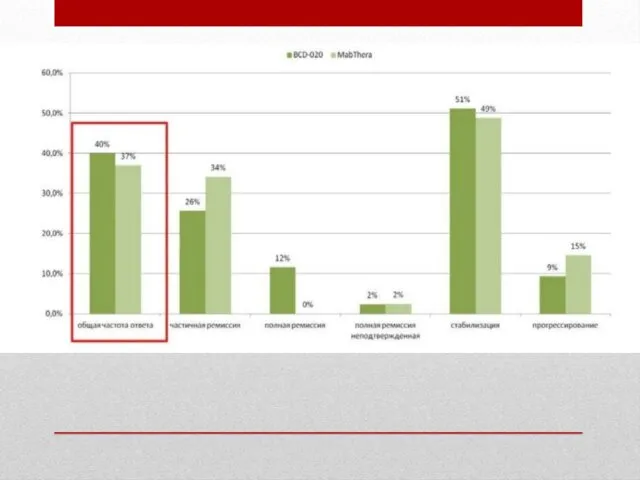
Начальная терапия, 4 еженедельных введения. В мультицентровом открытом исследовании при проведении 4 инфузий ритуксимаба (N=166), критериями исключения из которого были большие опухоли (более 10 см) или число лимфоцитов периферической крови более 5000 клеток/мкл. Суммарная частота ремиссии составила 48%, полной ремиссии — 6%, частичной ремиссии — 42%. Медиана времени до начала ответа на терапию была 50 дней и медиана времени до прогрессирования заболевания у больных, отвечающих на терапию, равнялась 11,2 мес (диапазон от 1,9 до 42,1+, «+» означает текущий ответ). Связанные с заболеванием признаки и симптомы (включая В-симптомы) присутствовали у 23% (39/166) пациентов в начале исследования и исчезали у 64% (25/39) из этих пациентов.
Многовариантный анализ показал, что суммарная частота ремиссии у пациентов с гистологическими подтипами опухоли B, C и D (по классификации IWF — International Working Formulation) была выше, чем с подтипом A (58 и 12% соответственно); у больных с наибольшим опухолевым очагом диаметром менее 5 см — выше, чем с очагом диаметром более 7 см (53 и 38%) и у больных с химиочувствительным рецидивом — выше, чем с химиоустойчивым (определяемым как продолжительность ремиссии менее 3 мес) (53 и 36% соответственно). Суммарная частота ремиссии у пациентов, ранее перенесших аутологическую пересадку костного мозга, достигала 78% (18/23). Такие факторы, как возраст ≥60 лет, экстранодальная локализация поражений, предшествующая терапия антрациклинами и поражение костного мозга, не коррелировали с более низкой частотой ремиссии.
Начальная терапия, 8 еженедельных введений. В мультицентровом исследовании, аналогичном предыдущему, при проведении 8 инфузий ритуксимаба (N=37), суммарная частота ремиссии составила 57%, полной ремиссии — 14%, частичной ремиссии — 43%, медиана времени до прогрессирования заболевания у больных, отвечающих на терапию — 13,4 мес (диапазон от 2,5 до 36,5+).
Эффективность терапии у пациентов с большой (более 10 см в диаметре) опухолевой массой (N=39) несколько ниже (суммарная частота ремиссии — 36%), при повторном лечении (N=60) она также несколько ниже (38%).
Применение у пациентов пожилого возраста. При проведении клинических испытаний 24% больных были в возрасте от 65 до 75 лет, 5% — от 75 лет и старше. Значимых различий в продолжительности времени ответа на терапию и частоте и выраженности побочных эффектов у пожилых людей по сравнению с этими же параметрами в возрастной группе пациентов до 65 лет не обнаружено.
Клинические исследования
В исследования были включены больные (N=296) c рецидивирующей или резистентной к терапии B-клеточной неходжкинской лимфомой низкой степени злокачественности или фолликулярной. Режимы дозирования были различными: больные получали ритуксимаб в дозе 375 мг/м2 в виде в/в инфузий, проводимых с интервалом в одну неделю, — 4 инфузии (N=166), либо 8 (N=37). Клинически эти исследования также различались, как первоначальное лечение, первоначальное лечение при большой опухолевой массе, повторное лечение.
Начальная терапия, 4 еженедельных введения. В мультицентровом открытом исследовании при проведении 4 инфузий ритуксимаба (N=166), критериями исключения из которого были большие опухоли (более 10 см) или число лимфоцитов периферической крови более 5000 клеток/мкл. Суммарная частота ремиссии составила 48%, полной ремиссии — 6%, частичной ремиссии — 42%. Медиана времени до начала ответа на терапию была 50 дней и медиана времени до прогрессирования заболевания у больных, отвечающих на терапию, равнялась 11,2 мес (диапазон от 1,9 до 42,1+, «+» означает текущий ответ). Связанные с заболеванием признаки и симптомы (включая В-симптомы) присутствовали у 23% (39/166) пациентов в начале исследования и исчезали у 64% (25/39) из этих пациентов.
Многовариантный анализ показал, что суммарная частота ремиссии у пациентов с гистологическими подтипами опухоли B, C и D (по классификации IWF — International Working Formulation) была выше, чем с подтипом A (58 и 12% соответственно); у больных с наибольшим опухолевым очагом диаметром менее 5 см — выше, чем с очагом диаметром более 7 см (53 и 38%) и у больных с химиочувствительным рецидивом — выше, чем с химиоустойчивым (определяемым как продолжительность ремиссии менее 3 мес) (53 и 36% соответственно). Суммарная частота ремиссии у пациентов, ранее перенесших аутологическую пересадку костного мозга, достигала 78% (18/23). Такие факторы, как возраст ≥60 лет, экстранодальная локализация поражений, предшествующая терапия антрациклинами и поражение костного мозга, не коррелировали с более низкой частотой ремиссии.
Начальная терапия, 8 еженедельных введений. В мультицентровом исследовании, аналогичном предыдущему, при проведении 8 инфузий ритуксимаба (N=37), суммарная частота ремиссии составила 57%, полной ремиссии — 14%, частичной ремиссии — 43%, медиана времени до прогрессирования заболевания у больных, отвечающих на терапию — 13,4 мес (диапазон от 2,5 до 36,5+).
Эффективность терапии у пациентов с большой (более 10 см в диаметре) опухолевой массой (N=39) несколько ниже (суммарная частота ремиссии — 36%), при повторном лечении (N=60) она также несколько ниже (38%).
Применение у пациентов пожилого возраста. При проведении клинических испытаний 24% больных были в возрасте от 65 до 75 лет, 5% — от 75 лет и старше. Значимых различий в продолжительности времени ответа на терапию и частоте и выраженности побочных эффектов у пожилых людей по сравнению с этими же параметрами в возрастной группе пациентов до 65 лет не обнаружено.
В исследования были включены больные (N=296) c рецидивирующей или резистентной к терапии B-клеточной НХЛ низкой степени злокачественности.
Режимы дозирования были различными: больные получали ритуксимаб в дозе 375 мг/м2 в виде в/в инфузий, проводимых с интервалом в одну неделю — 4 инфузии (N=166), либо 8 (N=37).
Клинически эти исследования также различались, как первоначальное лечение, первоначальное лечение при большой опухолевой массе, повторное лечение.
Начальная терапия, 4 еженедельных введения.
Суммарная частота ремиссии составила 48%, полной ремиссии — 6%, частичной ремиссии — 42%. Медиана времени до начала ответа на терапию была 50 дней и медиана времени до прогрессирования заболевания у больных, отвечающих на терапию, равнялась 11,2 мес. Связанные с заболеванием признаки и симптомы (включая В-симптомы) присутствовали у 23% (39/166) пациентов в начале исследования и исчезали у 64% (25/39) из этих пациентов.
Начальная терапия, 8 еженедельных введений.
суммарная частота ремиссии составила 57%, полной ремиссии — 14%, частичной ремиссии — 43%, медиана времени до прогрессирования заболевания у больных, отвечающих на терапию — 13,4 мес.
Клинические исследования
Ацеллбия® — это биоаналог оригинального ритуксимаба (Mabthera®; Hoffman-La Roche)
Ацеллбия® — это биоаналог оригинального ритуксимаба (Mabthera®; Hoffman-La Roche)
Спасибо за внимание !
Спасибо за внимание !
https://druginfo.nlm.nih.gov/drugportal/name/Rituximab
https://toxnet.nlm.nih.gov/
https://www.ncbi.nlm.nih.gov/
https://www.pubmedhealth/
https://druginfo.nlm.nih.gov/drugportal/name/Rituximab
https://toxnet.nlm.nih.gov/
https://www.ncbi.nlm.nih.gov/
https://www.pubmedhealth/
Что делает Ритуксимаб? (пенсильвания)
Это моноклональное антитело против молекулы CD20, расположенной на
Что делает Ритуксимаб? (пенсильвания)
Это моноклональное антитело против молекулы CD20, расположенной на
А как сделать так, чтобы вырубить только ауто-реактивные лимфоциты, а нормальные не трогать? До сих пор решения этой проблемы не было. Но скоро может появиться…chimeric antigen receptor
Вкратце, суть метода в том, что исследователь берет цитотоксический Т-лимфоцит и заменяет его природный Т-клеточный рецептор на другую конструкцию, например так: то, что внутри Т-лимфоцита – будет от Т-клеточного рецептора, а то, что снаружи – от моноклонального антитела против определенной мишени.
Что это дает? Это позволяет «натравить» Т-лимфоцит на нативный антиген (представленный без комплекса МНС), например, на рецептор В-лимфоцита специфичный против ауто-антигена.
Антитело – это растворимая форма В-клеточного рецептора, расположенного на мембране В-клетки. Если ты помнишь – каждый зрелый В- и Т-лимфоцит имеет рецепторы и способен продуцировать антитела только против одной конкретной мишени. Например, против Dsg3. Значит, чтобы победить болезнь – не нужно вырубать все В-лимфоциты, нужно убить только те, что несут на своей мембране В-клеточный рецептор против Dsg3.
Исследователи взяли цитотоксический Т-лимфоцит и создали конструкцию CAR-T, в которой внешняя
Исследователи взяли цитотоксический Т-лимфоцит и создали конструкцию CAR-T, в которой внешняя
Что получилось? Получился Т-лимфоцит-убийца, который подманивает ауто-реактивный В-лимфоцит как будто бы молекулой Dsg3.
В-лимфоцит своими рецепторами против Dsg3 связывается с химерической конструкцией измененного цитотоксического Т-лимфоцита, и далее Т-лимфоцит делает то, для чего он предназначен – убивает В-лимфоцит.
*Ритуксимаб (Мабтера) 100 мг цена
1 упаковка- 890 евро
Персонализированная терапия излечила рак крови у мышей
Американские ученые разработали новый метод
Персонализированная терапия излечила рак крови у мышей
Американские ученые разработали новый метод
Сотрудники Стэнфордского университета выбрали в качестве мишени для терапии вариабельный участок В-клеточного рецептора, известный как идиотип. Он высокоспецифичен для клеток опухоли и отличается от здоровых В-лимфоцитов. В то же время, идиотип опухолевых клеток индивидуален для конкретного пациента, что делает применение готовых моноклональных антител непрактичным.
Исследователи предложили определять структуру идиотипа у каждого пациента. Затем в существующих библиотеках подбирается небольшой пептид со сродством к этому идиотипу, который синтезируют химически. В это время у пациента забирают антитела и отделяют от них неизменяемые фрагменты, способные к кристаллизации (Fc). Синтезированный пептид химически связывают с Fc, получая высокоспецифическое в отношении конкретной опухоли полусинтетическое пептидное антитело (peptibody).
В ходе эксперимента in vitro пептидные антитела в течение 24 часов
В ходе эксперимента in vitro пептидные антитела в течение 24 часов
Эксперимент на иммунодефицитных мышах с пересаженной человеческой лимфомой показал, что период полувыведения пептидных антител из плазмы крови составляет около 24 часов. Их четырехкратное введение с интервалом в сутки привело к полному рассасыванию опухолей у всех животных, получивших терапию, при этом у мышей из контрольной группы наблюдался интенсивный рост новообразований.
«Пептидные антитела втрое меньше обычных антител по молекулярной массе, что обеспечивает их лучшее проникновение в ткани; они позволяют одной молекуле содержать более двух антигенсвязывающих участков, что повышает авидность к мишени», — пишут исследователи.
























 Деонтология в хирургии
Деонтология в хирургии Черепно-лицевые дизостозы
Черепно-лицевые дизостозы Гериатрические аспекты сердечно-сосудистых заболеваний
Гериатрические аспекты сердечно-сосудистых заболеваний Санаторий Радуга
Санаторий Радуга Передние и задние гастроэнтероанастомозы
Передние и задние гастроэнтероанастомозы Принципы сбалансированного питания
Принципы сбалансированного питания Первая медицинская помощь при острой сердечной недостаточности и инсульте
Первая медицинская помощь при острой сердечной недостаточности и инсульте Функциональные методы исследования зубочелюстных аномалий
Функциональные методы исследования зубочелюстных аномалий Нагноительные заболевания легких
Нагноительные заболевания легких Психико-соционический подход в обучении
Психико-соционический подход в обучении Диффдиагноз синдрома гиперкортицизма
Диффдиагноз синдрома гиперкортицизма Динамическое или психодинамическое направление в психотерапии. Разновидности психоанализа
Динамическое или психодинамическое направление в психотерапии. Разновидности психоанализа Медицинское волонтёрство: как всё начиналось (по материалам социологического исследования
Медицинское волонтёрство: как всё начиналось (по материалам социологического исследования Инфекционное бесплодие у женщин
Инфекционное бесплодие у женщин Медицина Московского государства (XV – XVII вв.). Лекция 8
Медицина Московского государства (XV – XVII вв.). Лекция 8 Хирургия желудка и кишечника
Хирургия желудка и кишечника Желчнокаменная болезнь (ЖКБ)
Желчнокаменная болезнь (ЖКБ) Конфлікти в організаціях: виникнення, причини, типи, профілактика, шляхи вирішення
Конфлікти в організаціях: виникнення, причини, типи, профілактика, шляхи вирішення Разработка комплекса для диагностики СДВГ у детей раннего дошкольного возраста
Разработка комплекса для диагностики СДВГ у детей раннего дошкольного возраста Эхокардиография
Эхокардиография Результаты анкетирования на тему о влиянии коронавирусной инфекции на детский организм
Результаты анкетирования на тему о влиянии коронавирусной инфекции на детский организм Особенности течения ХОБЛ в сочетании с гипертонической болезнью
Особенности течения ХОБЛ в сочетании с гипертонической болезнью Психология общения
Психология общения Омертвения. Свищи. Язвы
Омертвения. Свищи. Язвы Исследования лейкоцитов и тромбоцитов в крови
Исследования лейкоцитов и тромбоцитов в крови Фебрильная шизофрения
Фебрильная шизофрения Организация питания в ЛПУ. Работа пищеблока
Организация питания в ЛПУ. Работа пищеблока Гештальт терапия
Гештальт терапия