Содержание
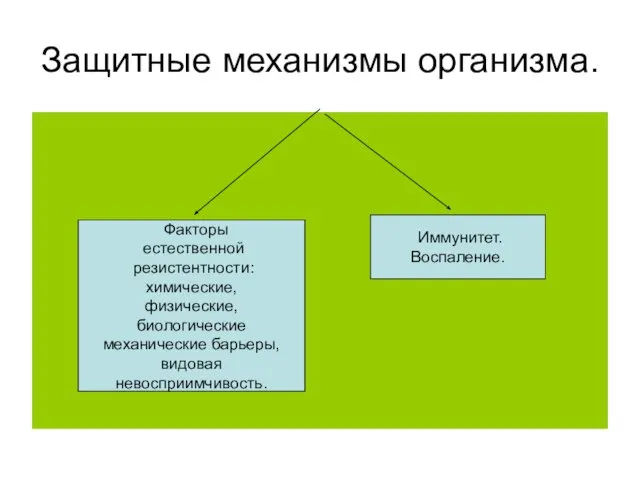
- 2. Защитные механизмы организма. Факторы естественной резистентности: химические, физические, биологические механические барьеры, видовая невосприимчивость. Иммунитет. Воспаление.
- 3. Воспаление как защитный механизм. Единичная бактериальная клетка – бинарное деление пополам каждые 50 мин. – 500
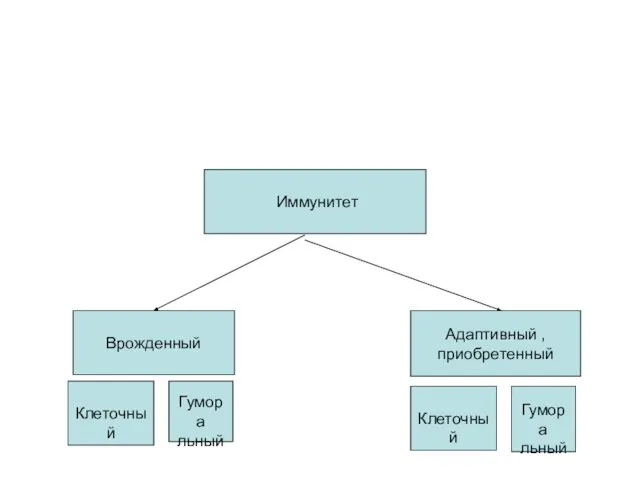
- 4. Иммунитет Врожденный Адаптивный , приобретенный Клеточный Гумора льный Клеточный Гумора льный
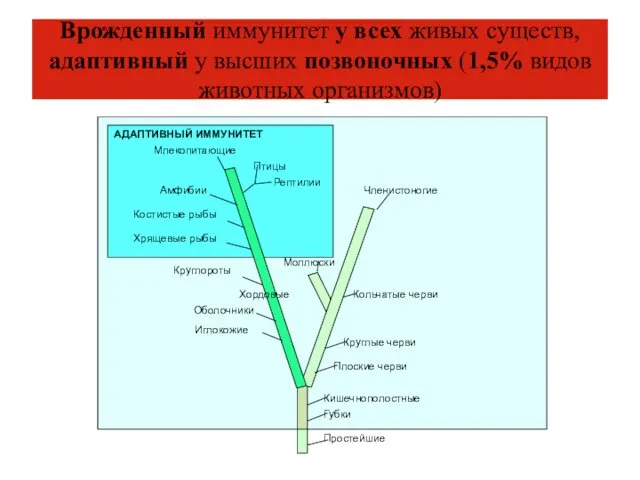
- 5. Врожденный иммунитет у всех живых существ, адаптивный у высших позвоночных (1,5% видов животных организмов)
- 6. Именно врожденный иммунитет является главной силой в борьбе с болезнями у всех живых существ. Приобретенный (адаптивный)
- 7. Врожденный иммунитет Первая линия защиты – быстрореагирующие (мин-часы), адаптивный 3-4 сут. Предсуществующие иммунные механизмы. Это самые
- 8. Передаются от родителей потомкам по наследству, т.е. генетически детерминирован.
- 9. Неспецифические ?????
- 10. Клеточные факторы врожденного иммунитета. Иммунные клетки: МФ, нейтрофилы, эозинофилы, базофилы, ДК, НК, НКТ, тучные клетки, В1,
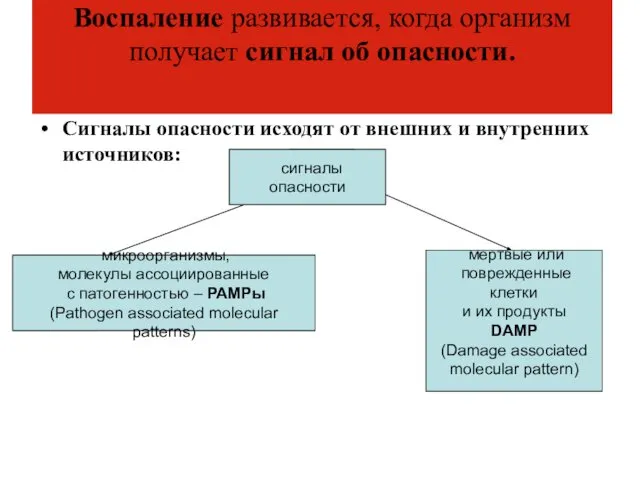
- 11. Воспаление развивается, когда организм получает сигнал об опасности. Сигналы опасности исходят от внешних и внутренних источников:
- 12. РАМРы – Это – группы молекул, отсутствующие в организме - хозяина, характерны для возбудителей, связаны с
- 13. Рецепторы, распознающие РАМРы. Патогенраспознающие рецепторы РRR имеются у всех многоклеточных, включая животных и растения. Узнавание образов
- 14. Сигнальные рецепторы. TLR, NLR, RIG-LR и др.
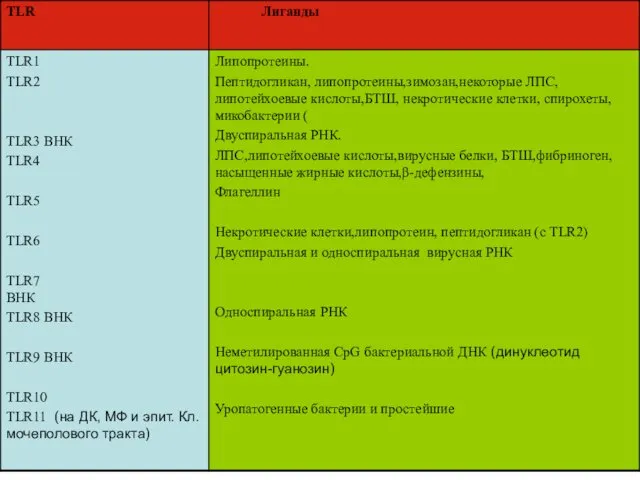
- 15. TLR 1. ТLR (Toll like receptоr) – рецепторы для РАМР-ов преимущественно на клетках или в клетках
- 16. Чарльз Джэнуэй (1943—2003). . Джэнуэй предположил, что рецепторы будут распознавать какие-то химические структуры, характерные для целого
- 17. Жюль Хоффманн три важнейших вывода: Во-первых, примитивная мушка-дрозофила наделена мощным и эффективным врождённым иммунитетом. Во-вторых, её
- 18. Дрозофилла, мутантная по гену Toll, заросла грибами и погибла, так как у неё нет иммунных рецепторов,
- 19. Руслан Меджитов Руслан Меджитов окончил Ташкентский университет, аспирантуру в МГУ, стал профессором Йельского университета (США) и
- 20. За открытия, касающиеся «Активации врожденного иммунитета» и «За открытие дендритных клеток и изучение их роли в
- 21. Нобелевская премия 2011 года. Премию делят Брюс Ботлер, профессор Университета Техаса в Далласе, и Жюль Хоффман
- 23. TLR могут кооперироваться для связывания с РАМР-ами TLR 2 +TLR6 TLR1+ TLR2 Есть основания предполагать, что
- 24. РАМРы и TLR
- 26. Сигнальные пути. Активирующий сигнал поступает в клетку. Это приводит к активации ядерного фактора транскрипции каппа В
- 27. РАМРы +TLR запускают продукцию различных смесей цитокинов. TLR , распознающие молекулы бактерий, сигнализируют о синтезе цитокинов,
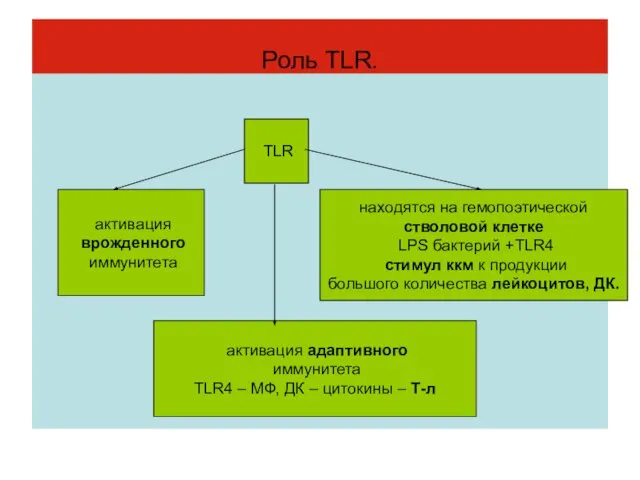
- 28. Роль TLR. TLR активация врожденного иммунитета активация адаптивного иммунитета TLR4 – МФ, ДК – цитокины –
- 29. Другие РRR млекопитающих. NLR (NOD – like receptor)- сигнальный рецептор, располагается внутри клетки. Распознают патоген в
- 30. RIG - like receptor. Находится в цитоплазме клеток, связывает вирусную РНК. Инициируют продукцию антивирусных цитокинов –
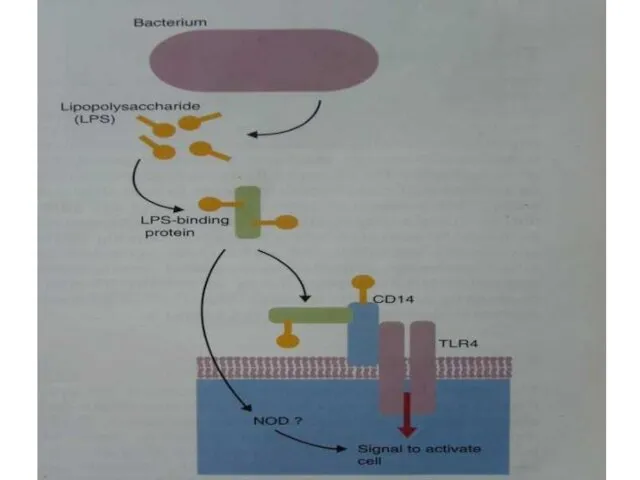
- 31. Другие РRR на поверхности клеток CD14 –бактериальные ЛПС CD1 – бактериальные гликолипиды. CD36 – бактериальные липопротеины,
- 33. Эндоцитозные рецепторы 1.Рецепторы для уборки мусора 2. Маннозные рецепторы
- 34. Рецепторы для уборки мусора SR (Scavenger receptors). Лиганды: липотейхоевые кислоты ГР+ бактерий, пептидогликан, ЛПС, частицы кремнезема,
- 35. Маннозный рецептор – MR. Распознает маннозу некоторых бактерий и вирусов. Подвергаются эндоцитозу, расщепляются внутриклеточными лизосомальными ферментами.
- 36. Секретируемые, растворимые PRR метят АГ для разрушения. Опсонины.
- 37. Опсонины – связываются с микробами и усиливают эндоцитоз (фагоцитоз): Комплемент С - реактивный белок (сем. пентраксинов)
- 38. PGRP –пептидогликан распознающий протеин. Обнаружен в гранулах нейтрофилов у человека, мышей, жвачных и свиней. Выходит из
- 39. DAMP (Damage associated molecular pattern) Гипотеза опасности – ответ клетки на какое-либо воздействие стресс-продуктами.
- 40. Стресс - молекулы собственного организма. Продукты стрессированных клеток в норме отсутствуют Остатки клеток при повреждении и
- 41. Распознавание стресс-молекул собственного организма. Взаимодействуют с TLR 2,4, синтез провоспалительных цитокинов, активация клеток врожденного иммунитета, развитие
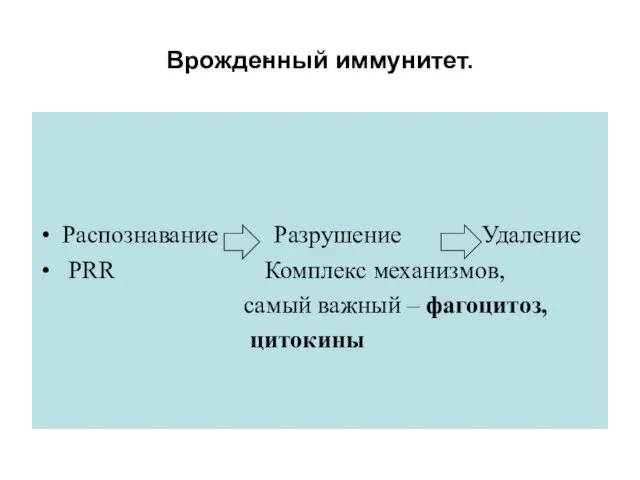
- 42. Врожденный иммунитет. Распознавание Разрушение Удаление PRR Комплекс механизмов, самый важный – фагоцитоз, цитокины
- 44. Скачать презентацию

































 Одышка и кашель
Одышка и кашель Модальные глаголы. Типы острой бактериальной пневмонии
Модальные глаголы. Типы острой бактериальной пневмонии Смешанные дистрофии
Смешанные дистрофии Аорта коартациясы
Аорта коартациясы Маркеры костеобразования
Маркеры костеобразования Симптоматология заболеваний печени и желчевыводящих путей
Симптоматология заболеваний печени и желчевыводящих путей Психолого-педагогическое обследование учащихся 5 классов в период адаптации при переходе в среднее звено
Психолого-педагогическое обследование учащихся 5 классов в период адаптации при переходе в среднее звено Обследование стоматологического больного
Обследование стоматологического больного Особенности периферической полинейропатии у больных сахарным диабетом 2 типа
Особенности периферической полинейропатии у больных сахарным диабетом 2 типа Термометрия. Уход при лихорадке
Термометрия. Уход при лихорадке Проверка доз в порошках
Проверка доз в порошках Хроническая обструктивная болезнь легких: ведение пациентов на амбулаторном этапе
Хроническая обструктивная болезнь легких: ведение пациентов на амбулаторном этапе Здравоохранение России
Здравоохранение России БЖА ісіктері бар науқастармен жұмыс жүргізгенде дәрігердің этикасы және диентологиясы
БЖА ісіктері бар науқастармен жұмыс жүргізгенде дәрігердің этикасы және диентологиясы Вредное влияние алкоголя, курения и наркотиков в период эмбрионального развития
Вредное влияние алкоголя, курения и наркотиков в период эмбрионального развития Острый рабдомиолиз. Необычные и стертые варианты злокачественной гипертермии
Острый рабдомиолиз. Необычные и стертые варианты злокачественной гипертермии Лучевая диагностика заболеваний органов дыхания
Лучевая диагностика заболеваний органов дыхания Развитие я-концепции. Психосексуальное развитие в ранней юности
Развитие я-концепции. Психосексуальное развитие в ранней юности Влияние компьютерных игр
Влияние компьютерных игр Характеристика диет номерной системы
Характеристика диет номерной системы Искусство спора и виды спора
Искусство спора и виды спора Невынашивание беременности
Невынашивание беременности Патронаж беременной и/или родильницы на дому с оформлением карты
Патронаж беременной и/или родильницы на дому с оформлением карты Легочная гипертензия
Легочная гипертензия Обмен отдельных аминокислот
Обмен отдельных аминокислот Пороки сердца
Пороки сердца Вегетарианство. За и против
Вегетарианство. За и против Дистрес плода під час вагітності та в пологах. Асфіксія новонароджених
Дистрес плода під час вагітності та в пологах. Асфіксія новонароджених