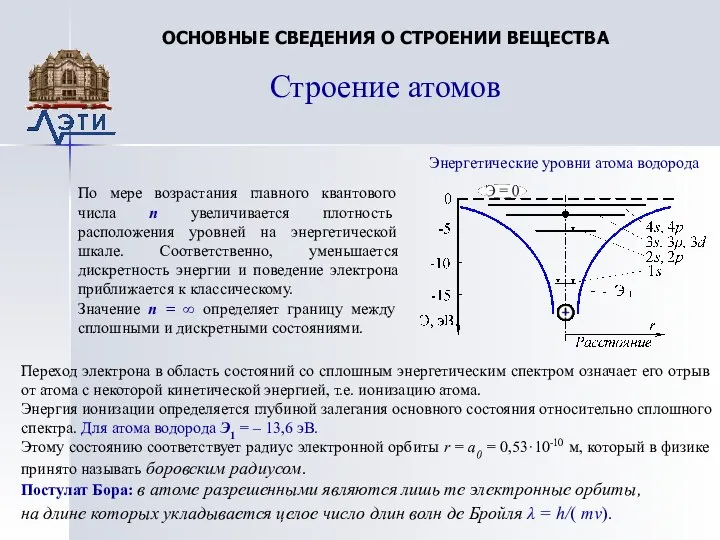
Энергетические уровни атома водорода
Строение атомов
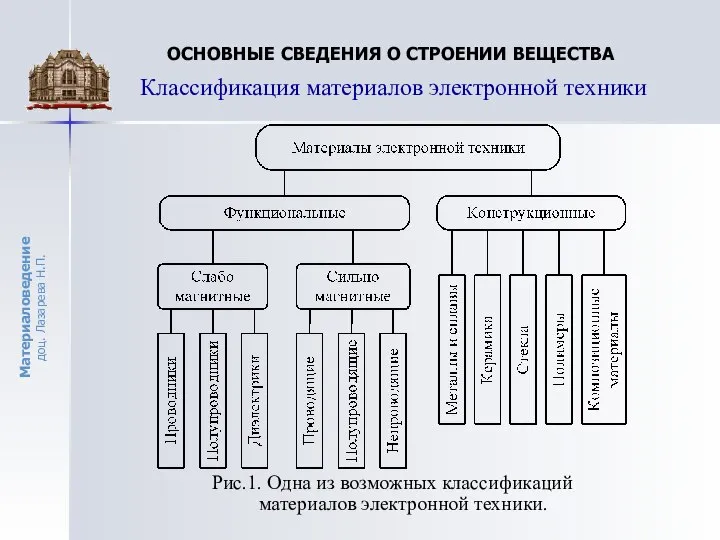
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
По мере
возрастания главного квантового числа n увеличивается плотность расположения уровней на энергетической шкале. Соответственно, уменьшается дискретность энергии и поведение электрона приближается к классическому.
Значение n = ∞ определяет границу между сплошными и дискретными состояниями.
Переход электрона в область состояний со сплошным энергетическим спектром означает его отрыв от атома с некоторой кинетической энергией, т.е. ионизацию атома.
Энергия ионизации определяется глубиной залегания основного состояния относительно сплошного спектра. Для атома водорода Э1 = – 13,6 эВ.
Этому состоянию соответствует радиус электронной орбиты r = a0 = 0,53·10-10 м, который в физике принято называть боровским радиусом.
Постулат Бора: в атоме разрешенными являются лишь те электронные орбиты,
на длине которых укладывается целое число длин волн де Бройля λ = h/( mv).







 «Мировое хозяйство и международная торговля.»
«Мировое хозяйство и международная торговля.» Тактики создания заголовков для рекламы в интернете
Тактики создания заголовков для рекламы в интернете Восточные славяне в древности
Восточные славяне в древности Цифровые автоматы
Цифровые автоматы Использование видео и аудио в HTML
Использование видео и аудио в HTML The rule of law
The rule of law Система линейных токов
Система линейных токов Право собственности и иные вещные права
Право собственности и иные вещные права  Менеджмент риска. Метод анализа видов и последствий отказов
Менеджмент риска. Метод анализа видов и последствий отказов Swimming isn`t hobby, swimming is diagnosis
Swimming isn`t hobby, swimming is diagnosis Презентация на тему "ФГОС дошкольного образования: содержание, проблемы, риски" - скачать презентации по Педагогике
Презентация на тему "ФГОС дошкольного образования: содержание, проблемы, риски" - скачать презентации по Педагогике Ислам. История возникновения
Ислам. История возникновения Реляционное исчисление
Реляционное исчисление САРКОИДОЗ Выполнила Вьюшкова К.Д. 615 гр, ВОП
САРКОИДОЗ Выполнила Вьюшкова К.Д. 615 гр, ВОП Священное Писание Нового Завета. Введение в науку. Эпистолярный жанр
Священное Писание Нового Завета. Введение в науку. Эпистолярный жанр Детская лесная республика «Гамаюния»
Детская лесная республика «Гамаюния» Механизированный путевой инструмент
Механизированный путевой инструмент Введение в Пролог
Введение в Пролог Наём, отбор и приём персонала
Наём, отбор и приём персонала СУЛЬФОНОВЫЕ КИСЛТЫ
СУЛЬФОНОВЫЕ КИСЛТЫ Ученическая конференция на тему «Что такое ученический проект?»
Ученическая конференция на тему «Что такое ученический проект?» Электрические нагрузки. (Лекция 2)
Электрические нагрузки. (Лекция 2) Исчезающие животные (Англ)
Исчезающие животные (Англ)  Мобильные устройства самообслуживания
Мобильные устройства самообслуживания Изменение магнитных свойств
Изменение магнитных свойств Научно-исследовательская работа по теме: «Фальсификация алкогольной продукции» Выполнили: студенты 2 курса очной формы обучени
Научно-исследовательская работа по теме: «Фальсификация алкогольной продукции» Выполнили: студенты 2 курса очной формы обучени BRAND
BRAND Квалиметрия услуг
Квалиметрия услуг