Содержание
- 2. 1капля избытка AgNo3 K2 CrO4 + 2 AgNO3→ Ag2 CrO4 ↓+2KNO3 Определяют —:СI, —:Br, —:Yкрасного цвета
- 3. 1.Недостатки: 1.строго рН = 7, многие б.ж. рН 2. Мешают определению анионы: PO-34; H2PO—4; HPO—4; С2O42-;
- 4. Метод Фольгарда: Точность 10-6г. Рабочие растворы: AgNO3; K NCS или NH4NCS Индикатор: железоаммианные квасцы- FeNH4 (SO4)2
- 5. Определения по избытку: Пример: Определить m-:CI в моче Моча разбавляется в 100 раз. (Суточное выделение 1200мл)
- 6. сэ= 0,1 моль Точный V и в избытке + 6капель FeNH4 (SO4)2 ∙12H2O пипеткой (5 мл.)
- 8. Скачать презентацию





 Консультация для учителей-логопедов Выполнила: учитель-логопед МКДОУ комбинированного вида д/с №11 «Чебурашка» г.Пласта Гончаре
Консультация для учителей-логопедов Выполнила: учитель-логопед МКДОУ комбинированного вида д/с №11 «Чебурашка» г.Пласта Гончаре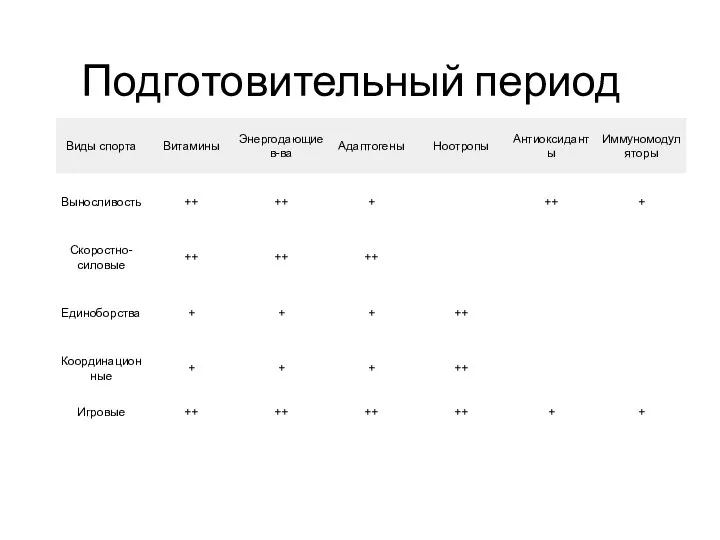 Виды спорта. Препараты
Виды спорта. Препараты Lambda engine
Lambda engine Этапы развития ОАО Нафтан
Этапы развития ОАО Нафтан Презентация на тему "Наша новая школа" - скачать презентации по Педагогике
Презентация на тему "Наша новая школа" - скачать презентации по Педагогике СТРОМАЛЬНО - СОСУДИСТЫЕ ДИСТРОФИИ
СТРОМАЛЬНО - СОСУДИСТЫЕ ДИСТРОФИИ Уроки китайского языка
Уроки китайского языка Введение в язык UML (Продолжение)
Введение в язык UML (Продолжение) Россия
Россия Основные законы термодинамики в осадочном процессе
Основные законы термодинамики в осадочном процессе Замок Нойшванштан
Замок Нойшванштан Ожирение вредит здоровью Работу выполнила: Балабина Наталья ученица 10 класса 2008г.
Ожирение вредит здоровью Работу выполнила: Балабина Наталья ученица 10 класса 2008г. Проверь себя Объясни смысл понятий «социальная среда», «прямое влияние окружающих», «косвенное влияние». Приведите примеры прям
Проверь себя Объясни смысл понятий «социальная среда», «прямое влияние окружающих», «косвенное влияние». Приведите примеры прям Litania do Św. Stanisława Kostki
Litania do Św. Stanisława Kostki Организация деятельности музея. Музеефикация
Организация деятельности музея. Музеефикация Урок – телепередача. Девіз уроку. Працюй наполегливо, швидко, старанно, щоб жодна хвилинка не втратилась марно
Урок – телепередача. Девіз уроку. Працюй наполегливо, швидко, старанно, щоб жодна хвилинка не втратилась марно Принципы занятий физическими упражнениями
Принципы занятий физическими упражнениями Эффект волшебного стекла Знакомство с понятиями гиперболы и литоты
Эффект волшебного стекла Знакомство с понятиями гиперболы и литоты  Фонтан Дубай
Фонтан Дубай Теория вероятностей и математическая статистика Введение в теорию вероятностей
Теория вероятностей и математическая статистика Введение в теорию вероятностей Первобытная магия и ритуалы
Первобытная магия и ритуалы Презентация "Аукцион" - скачать презентации по Экономике
Презентация "Аукцион" - скачать презентации по Экономике Астраханский Кремль Подготовила воспитатель Зюзина Татьяна Владимировна,ГСКУ Енотаевский приют для детей «Любава»
Астраханский Кремль Подготовила воспитатель Зюзина Татьяна Владимировна,ГСКУ Енотаевский приют для детей «Любава» Локальная компьютерная сеть
Локальная компьютерная сеть Приказки на Граматиката Приказка за едно изречение
Приказки на Граматиката Приказка за едно изречение Урок математики в 3 классе Тема: «Формула произведения» УМК «ШКОЛА 2100» Учитель начальных классов МОУ гимназии № 87 г. Краснода
Урок математики в 3 классе Тема: «Формула произведения» УМК «ШКОЛА 2100» Учитель начальных классов МОУ гимназии № 87 г. Краснода Служебное расследование
Служебное расследование 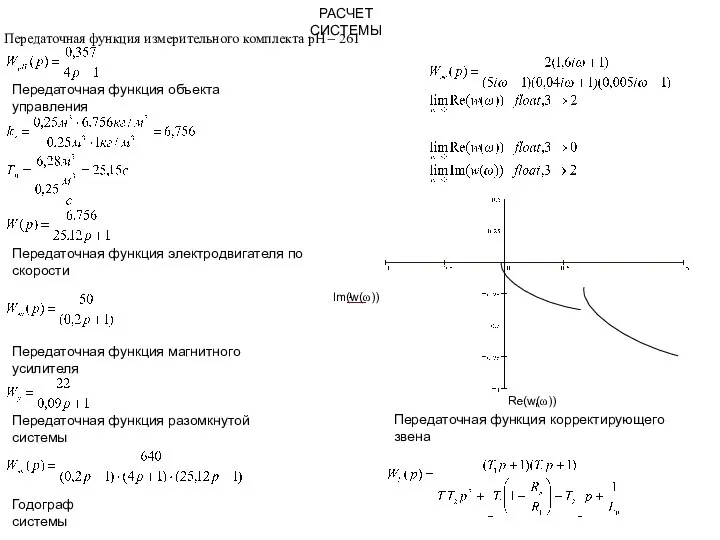 презентация1
презентация1