Содержание
- 2. Кислотные и основные свойства органических соединений Бренстед: Кислота – соединение, способное отдавать протон, основание – принимать
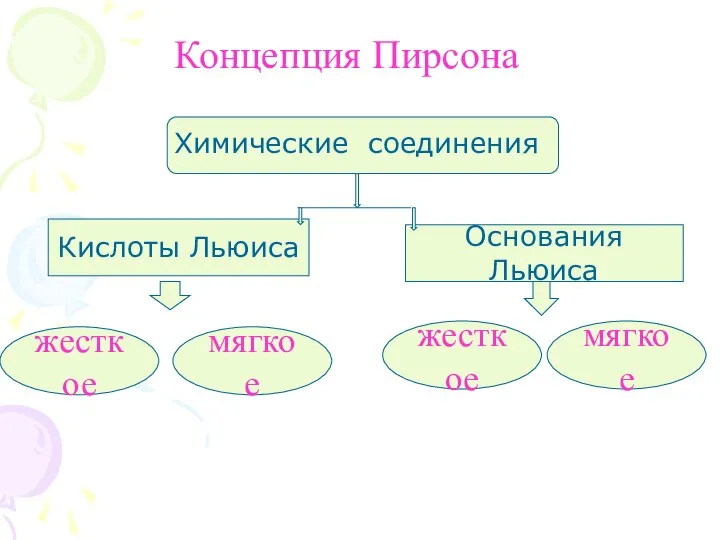
- 3. Концепция Пирсона Химические соединения Кислоты Льюиса Основания Льюиса жесткое мягкое жесткое мягкое
- 4. Ralph Pearson 1919, Chicago 1946, Ph.D, Northwestern University 1946-1976, University of California at Santa Barbara 1963г.,
- 5. Жесткие кислоты более легко и с образованием более прочных связей реагируют с жесткими основаниями, а мягкие
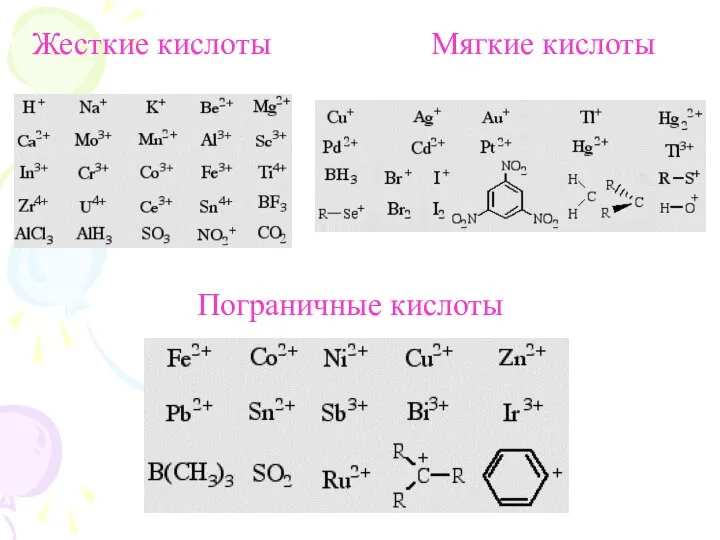
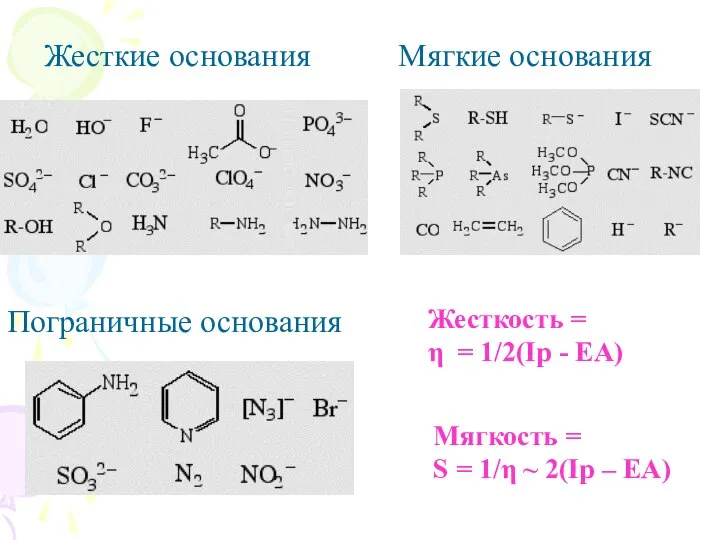
- 6. Жесткие кислоты Жесткие основания -низкая поляризуемость -низкая поляризуемость -малый объем -малый объем -высокое сродство к (e)
- 7. Мягкие кислоты Мягкие основания -высокая поляризуемость -высокая поляризуемость -большой объем -большой объем -низкая НВМО -высокая ВЗМО
- 8. Жесткие кислоты Мягкие кислоты Пограничные кислоты
- 9. Жесткие основания Мягкие основания Пограничные основания Жесткость = η = 1/2(Ip - EA) Мягкость = S
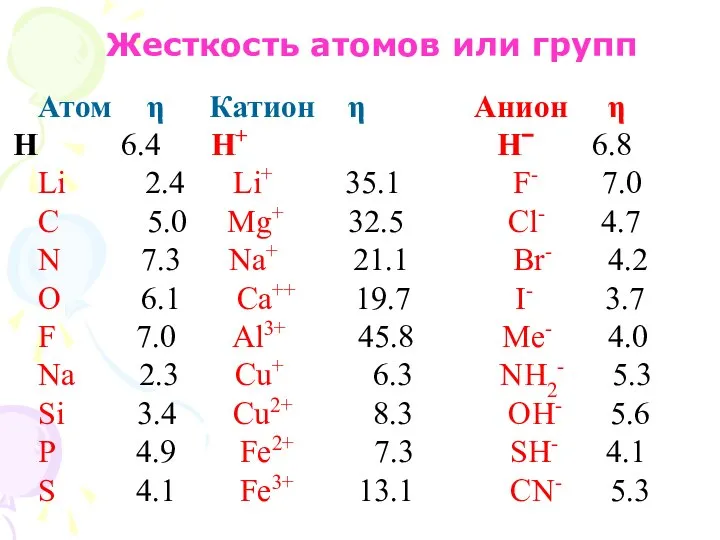
- 10. Жесткость атомов или групп Атом η Катион η Анион η 6.4 Η+ Η− 6.8 Li 2.4
- 11. Абсолютная жесткость: G = -[EВЗМО – EНСМО] Абсолютная электро- отрицательность: [ΕВЗМО + ЕНСМО] 2 χ =
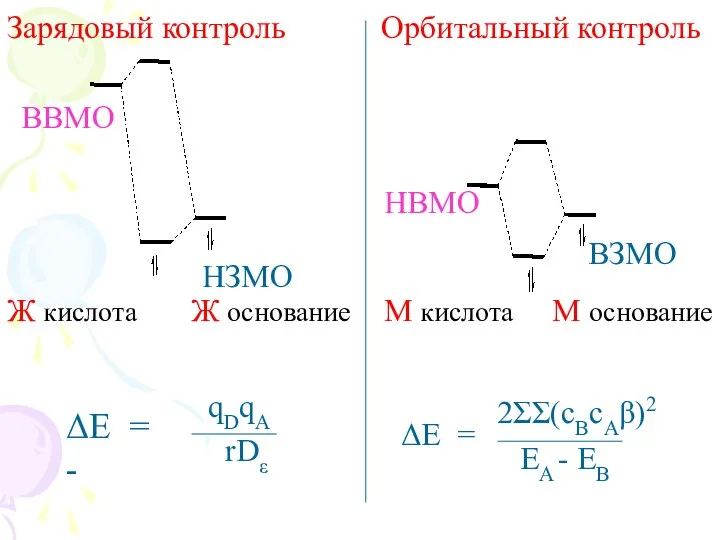
- 12. Зарядовый контроль Орбитальный контроль НЗМО ВВМО НВМО ВЗМО ΔE = - qDqA rDε ΔE = 2ΣΣ(cBcAβ)2
- 13. Подход Клопмана Кислоты En* = -(3Ip + EA)/4 + 14.39(q+0.5) Rион + 0.82 (1 - 1/ε)
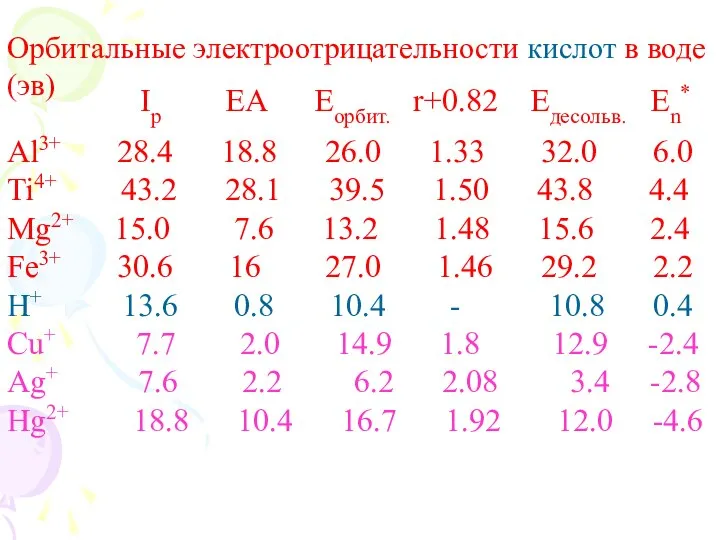
- 14. Орбитальные электроотрицательности кислот в воде (эв) Ip EA Eорбит. r+0.82 Eдесольв. En* Al3+ 28.4 18.8 26.0
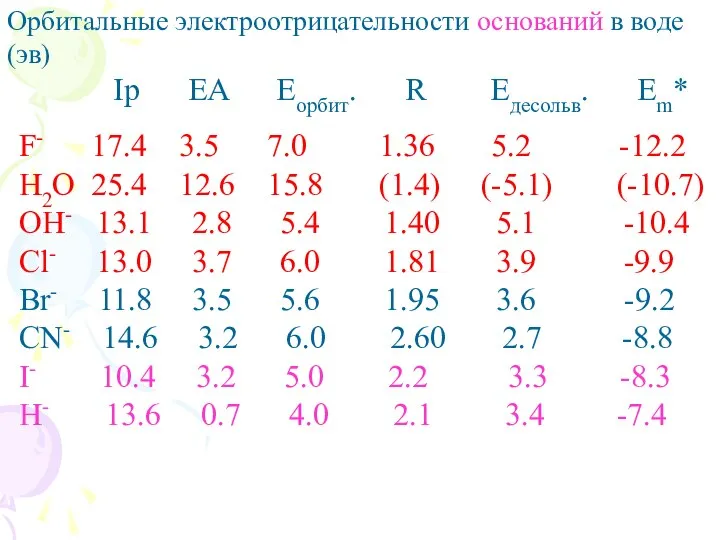
- 15. Орбитальные электроотрицательности оснований в воде (эв) Ip EA Eорбит. R Eдесольв. Em* F- 17.4 3.5 7.0
- 16. Уравнение Эдварса (1954 г.) lgK/Ko = aP + bH K – константа равновесия реакции основания B
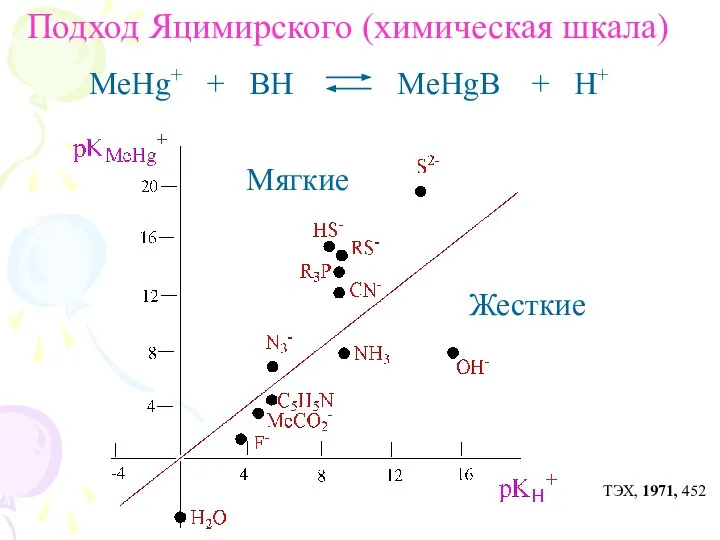
- 17. Подход Яцимирского (химическая шкала) MeHg+ + BH MeHgB + H+ Mягкие Жесткие ТЭХ, 1971, 452
- 18. Me-OH + H-I MeI + H-OH 1. В газовой фазе: Kp = [H2O] [MeI] [HI] [MeOH]
- 20. Скачать презентацию





![Абсолютная жесткость: G = -[EВЗМО – EНСМО] Абсолютная электро- отрицательность: [ΕВЗМО](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304026/slide-10.jpg)



 Саморегулируемая межрегиональная ассоциация специалистов-оценщиков СРО НП
Саморегулируемая межрегиональная ассоциация специалистов-оценщиков СРО НП выбор показателя адиабаты k2
выбор показателя адиабаты k2  Презентація роботи методичного об'єднання - презентация для начальной школы
Презентація роботи методичного об'єднання - презентация для начальной школы Агент Фофо разгадывает таинственные знаки - презентация для начальной школы
Агент Фофо разгадывает таинственные знаки - презентация для начальной школы Классификация и типы настольных игр
Классификация и типы настольных игр Сущность и структура государственно-правового механизма управления обеспечением прав и свобод человека и гражданина
Сущность и структура государственно-правового механизма управления обеспечением прав и свобод человека и гражданина МСФО 18 «Выручка» Понятие и оценка выручки Продажа товаров Предоставление услуг Проценты, лицензионные платежи и дивиденды Раск
МСФО 18 «Выручка» Понятие и оценка выручки Продажа товаров Предоставление услуг Проценты, лицензионные платежи и дивиденды Раск Предел последовательности - презентация по Алгебре
Предел последовательности - презентация по Алгебре истоки древнегреческой культуры
истоки древнегреческой культуры Презентация____
Презентация____ 1-наурыз Алғыс айту күні
1-наурыз Алғыс айту күні Gniel_MEN_Moscow_2010-рус
Gniel_MEN_Moscow_2010-рус Трудовые отношения между работодателем и работником
Трудовые отношения между работодателем и работником Живопись, театр, музыка, архитектура
Живопись, театр, музыка, архитектура Мышцы и кости
Мышцы и кости Православные праздники
Православные праздники Особенности powerpoint
Особенности powerpoint  Система управления персоналом
Система управления персоналом Кинематический анализ сооружений
Кинематический анализ сооружений Банкоматы Diebold Nixdorf. Курс базового уровня Б-004
Банкоматы Diebold Nixdorf. Курс базового уровня Б-004 А.В. Лисовский Разработка положения по оформлению и представлению квалификационной работы инженера
А.В. Лисовский Разработка положения по оформлению и представлению квалификационной работы инженера Функциональная анатомия органов мужской половой системы
Функциональная анатомия органов мужской половой системы Клебсиеллы. Выполнила: Червякова Елена, 249 ОМФ. Проверил: Дидар Муратович. Семей 2011
Клебсиеллы. Выполнила: Червякова Елена, 249 ОМФ. Проверил: Дидар Муратович. Семей 2011 Избирательная система: понятие, компоненты
Избирательная система: понятие, компоненты Улицы города Петропавловска: культурно-исторический аспект
Улицы города Петропавловска: культурно-исторический аспект Игры наших родителей
Игры наших родителей Презентация Иван Тихонович Посошков.
Презентация Иван Тихонович Посошков. Древний Китай
Древний Китай