Второе начало термодинамики. Понятие об экзэргонических и эндэргонических реакциях обмена. Принцип энергетического сопряжения
Содержание
- 2. Вступление I закон термодинамики позволяет определить ΔΗреакции, но не даёт ответа на вопрос о её направлении.
- 3. Второе начало термодинамики Энтропия (S) − мера рассеянной или обесцененной энергии. “Теплота сама по себе не
- 4. Второе начало термодинамики В самопроизвольном процессе В равновесном процессе Для изолированной системы, где Q = 0:
- 5. Статистическая природа S W – число различных состояний системы, доступное ей при данных условиях, или термодинамическая
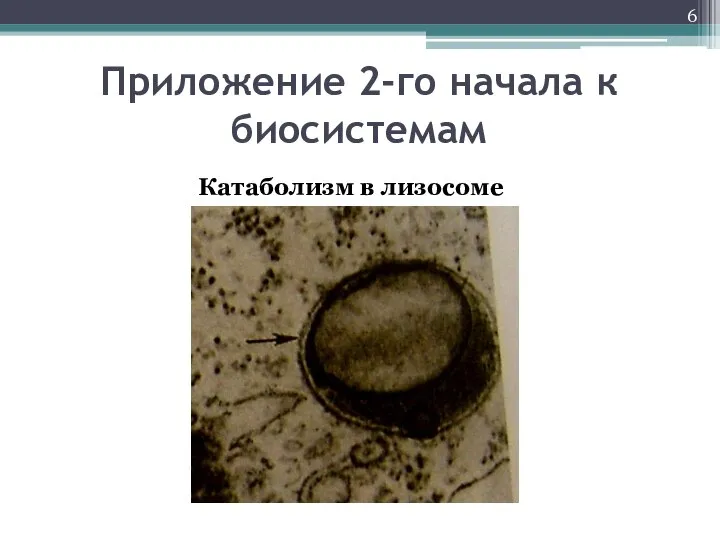
- 6. Приложение 2-го начала к биосистемам Катаболизм в лизосоме
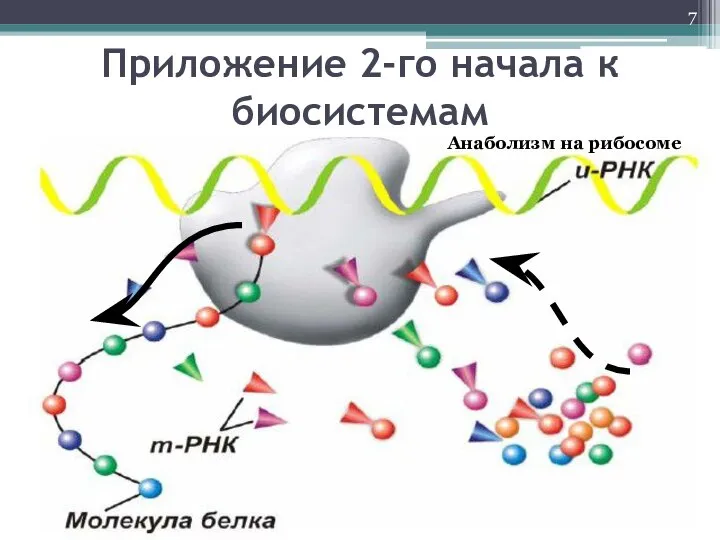
- 7. Приложение 2-го начала к биосистемам Анаболизм на рибосоме
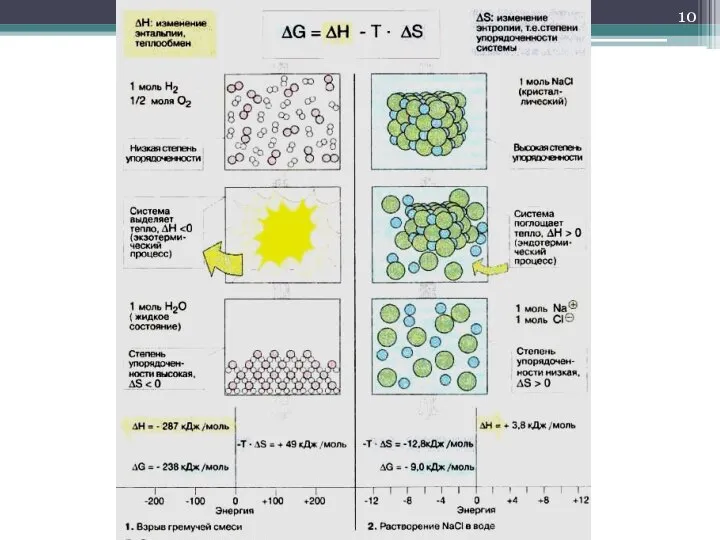
- 8. Уравнение Гиббса… … является объединённым выражением I и II начал термодинамики. Для данной температуры ΔG =
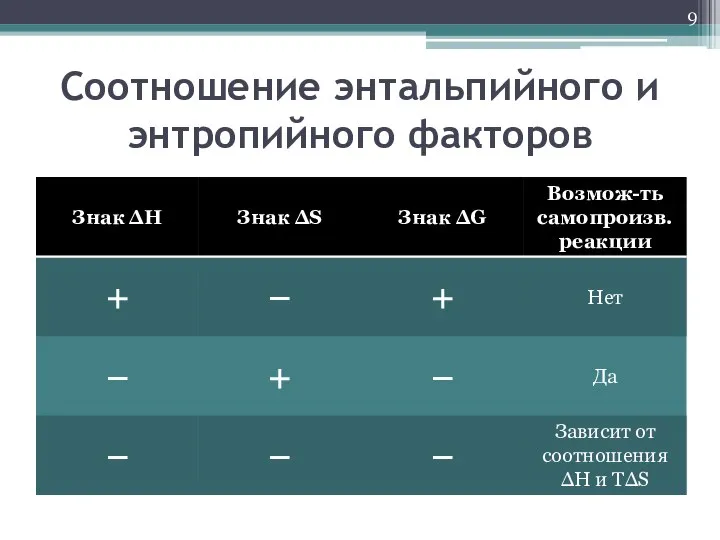
- 9. Соотношение энтальпийного и энтропийного факторов
- 11. Реакции обмена Экзэргонические − реакции обмена, идущие с выделением энергии (ΔG Эндэргонические − реакции обмена, идущие
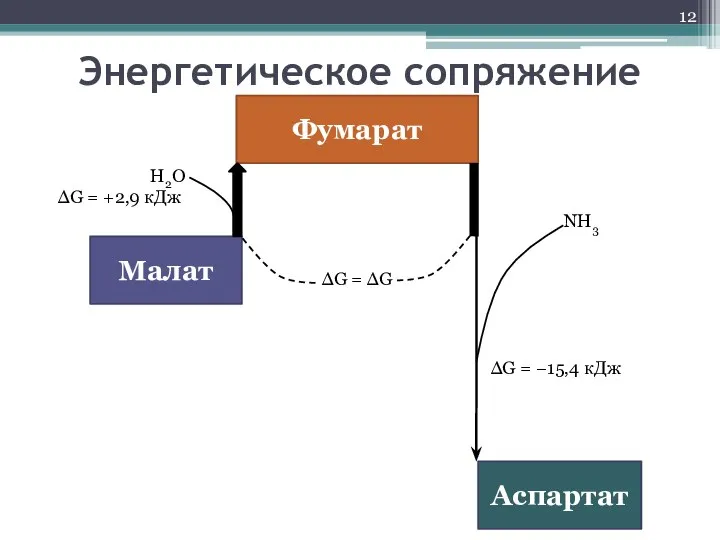
- 12. Энергетическое сопряжение
- 13. Макроэрги
- 15. Скачать презентацию







 Каналы передачи информации
Каналы передачи информации Презентация игра по таможенному делу
Презентация игра по таможенному делу Презентация "КРАСАУСКАС СТАСИС АЛЬГИРДО" - скачать презентации по МХК
Презентация "КРАСАУСКАС СТАСИС АЛЬГИРДО" - скачать презентации по МХК Экономика и ее роль в жизни общества. учитель МОУ СОШ №11 Ревякина Ольга Ивановна
Экономика и ее роль в жизни общества. учитель МОУ СОШ №11 Ревякина Ольга Ивановна  Характеристика искусства классицизма
Характеристика искусства классицизма Муниципальное дошкольное образовательное учреждение детский сад комбинированного вида №12 г. Сердобска
Муниципальное дошкольное образовательное учреждение детский сад комбинированного вида №12 г. Сердобска Временные ряды
Временные ряды  Презентация Применение книжки МДП
Презентация Применение книжки МДП Технологический процесс обработки детали заглушка
Технологический процесс обработки детали заглушка Формы, созданные в Лого
Формы, созданные в Лого N-арные деревья
N-арные деревья Презентация "Просветительские проекты" - скачать презентации по Экономике
Презентация "Просветительские проекты" - скачать презентации по Экономике Информация о ходе реализации приоритетного проекта «Формирование современной городской среды»
Информация о ходе реализации приоритетного проекта «Формирование современной городской среды» Экология как наука
Экология как наука Алгоритмы. 3 базовые управляющие алгоритмические структуры
Алгоритмы. 3 базовые управляющие алгоритмические структуры От норм ГТО – к олимпийским медалям
От норм ГТО – к олимпийским медалям Творческие проекты по духовному краеведению Подмосковья. «Двунадесятые праздники». Тема: «Рождество Пресвятой Богородицы»
Творческие проекты по духовному краеведению Подмосковья. «Двунадесятые праздники». Тема: «Рождество Пресвятой Богородицы» Требования по энергоэффективности зданий. Энергоаудит зданий
Требования по энергоэффективности зданий. Энергоаудит зданий Порядок возбуждения уголовного дела
Порядок возбуждения уголовного дела Растяжение и сжатие
Растяжение и сжатие Портрет инопланетянина. Викторина
Портрет инопланетянина. Викторина Зимний лагерь «ОЛИМП»
Зимний лагерь «ОЛИМП» Дыхание - 2
Дыхание - 2 Подготовка технического задания для электронных курсов
Подготовка технического задания для электронных курсов Электрические системы запуска ГТД и системы зажигания топлива
Электрические системы запуска ГТД и системы зажигания топлива Тема: «Влияние родителей на отношение подростков к курению»
Тема: «Влияние родителей на отношение подростков к курению» Презентация Возможность создания специального налогового режима в Крыму
Презентация Возможность создания специального налогового режима в Крыму Компьютерные сети
Компьютерные сети