Содержание
- 2. Предмет и задачи биоорганической химии Биоорганическая химия изучает строение и свойства веществ, участвующих в процессах жизнедеятельности,
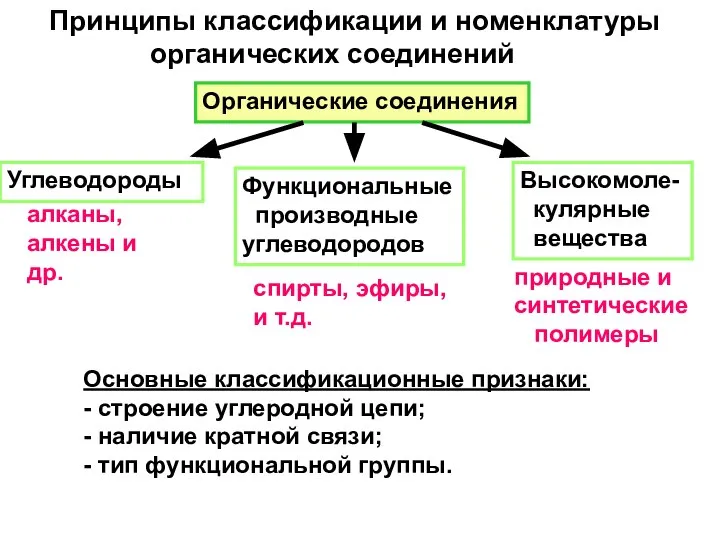
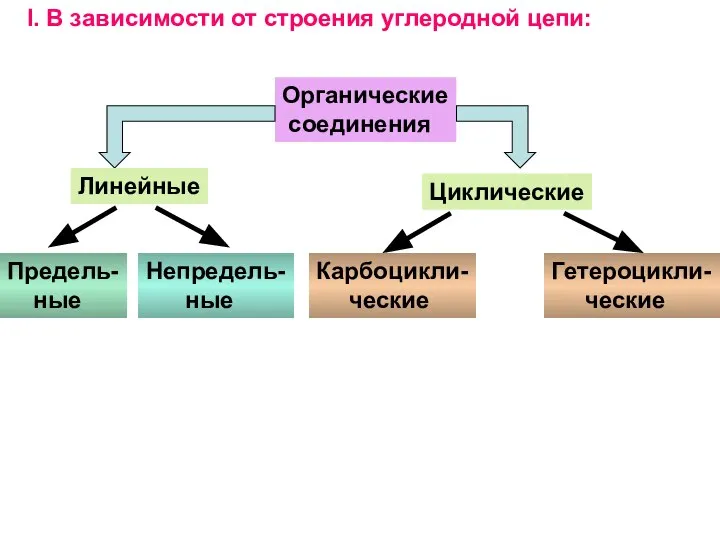
- 3. Принципы классификации и номенклатуры органических соединений Основные классификационные признаки: - строение углеродной цепи; - наличие кратной
- 4. Органические соединения Линейные Циклические Предель- ные Непредель- ные Карбоцикли- ческие Гетероцикли- ческие I. В зависимости от
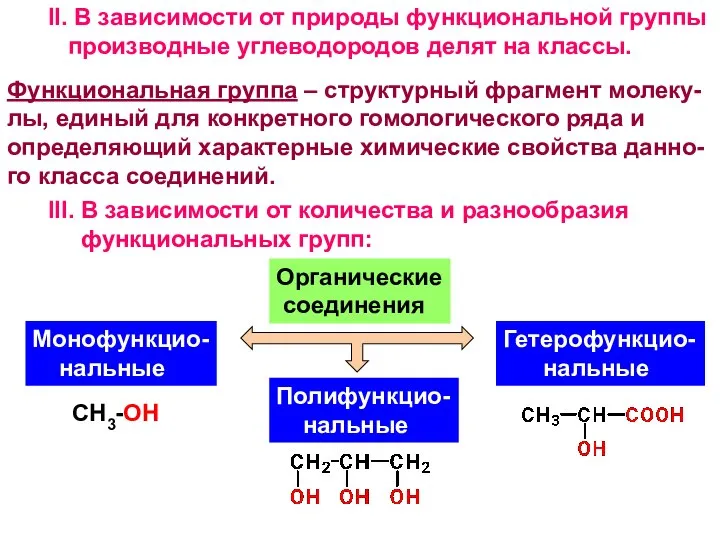
- 5. II. В зависимости от природы функциональной группы производные углеводородов делят на классы. Функциональная группа – структурный
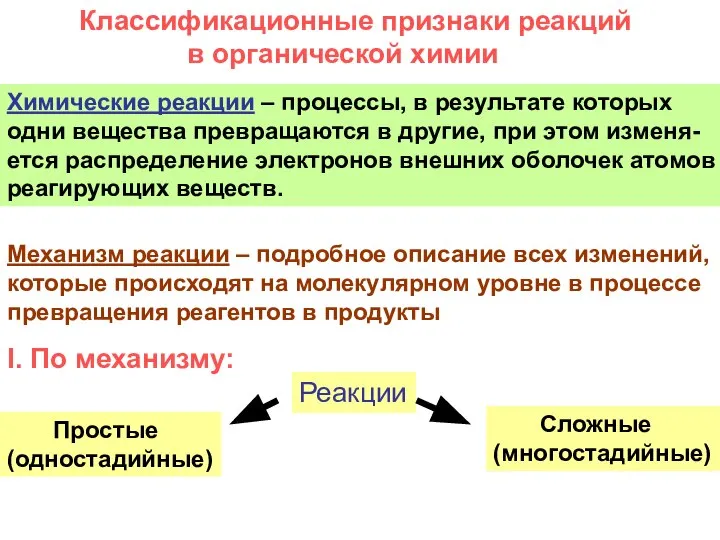
- 6. Классификационные признаки реакций в органической химии Химические реакции – процессы, в результате которых одни вещества превращаются
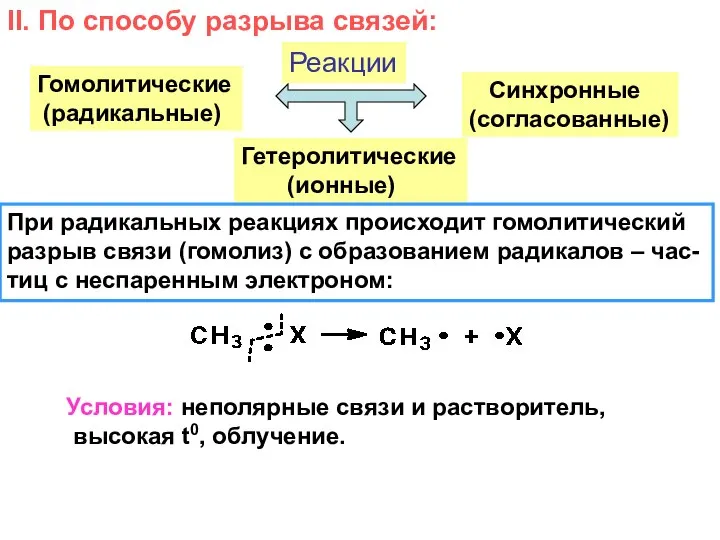
- 7. II. По способу разрыва связей: Реакции Гомолитические (радикальные) Гетеролитические (ионные) Синхронные (согласованные) При радикальных реакциях происходит
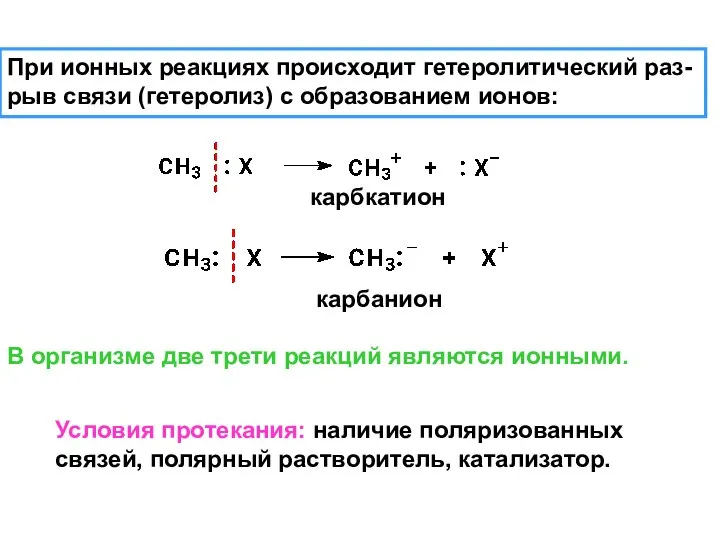
- 8. При ионных реакциях происходит гетеролитический раз- рыв связи (гетеролиз) с образованием ионов: В организме две трети
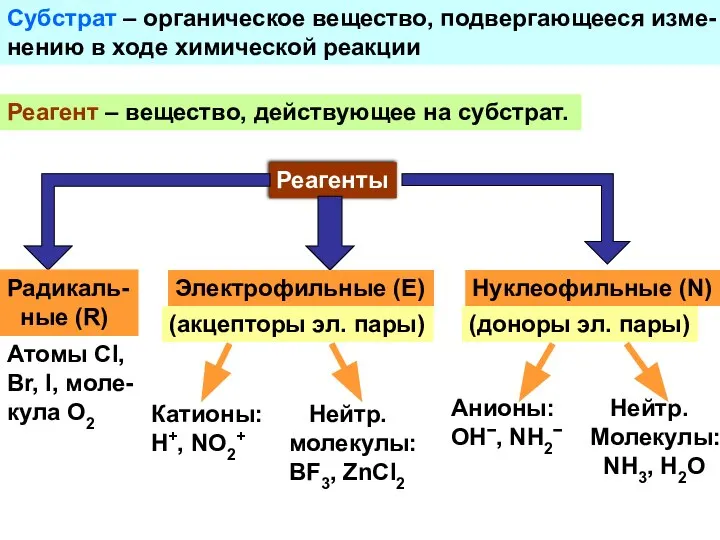
- 9. Субстрат – органическое вещество, подвергающееся изме- нению в ходе химической реакции Реагент – вещество, действующее на
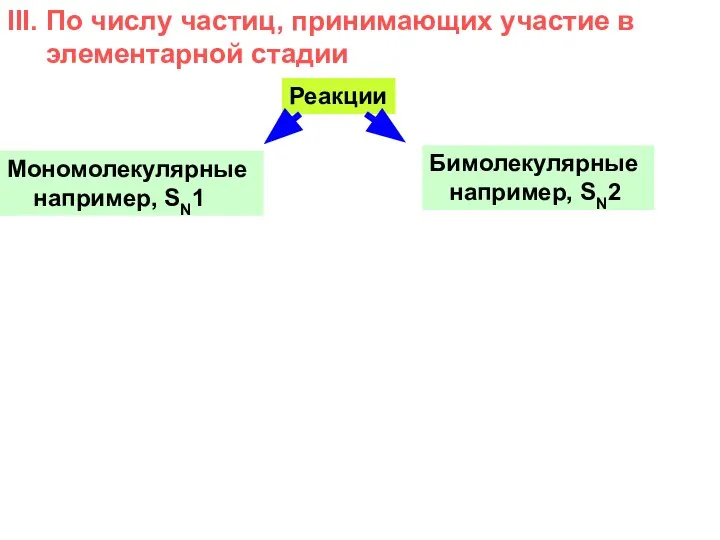
- 10. III. По числу частиц, принимающих участие в элементарной стадии Реакции Мономолекулярные например, SN1 Бимолекулярные например, SN2
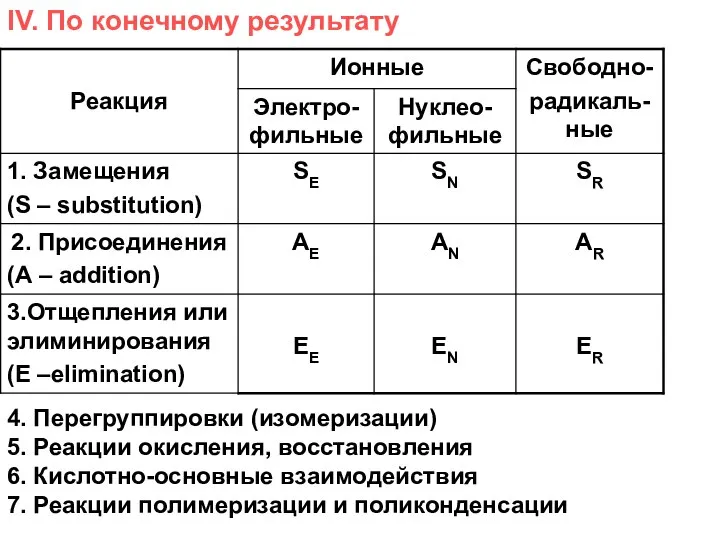
- 11. IV. По конечному результату 4. Перегруппировки (изомеризации) 5. Реакции окисления, восстановления 6. Кислотно-основные взаимодействия 7. Реакции
- 12. Структура и пространственное строение молекул. Виды изомерии. Явление существования индивидуальных химических соединений, одинаковых по молярной массе
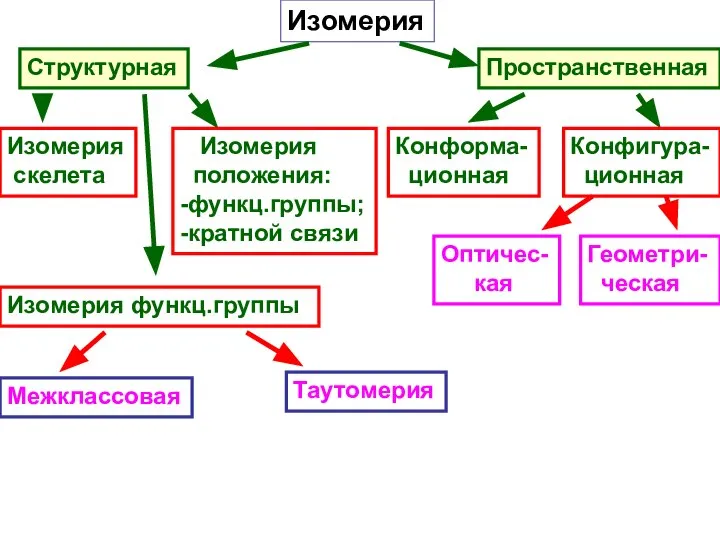
- 13. Изомерия Структурная Пространственная Изомерия скелета Изомерия положения: -функц.группы; -кратной связи Изомерия функц.группы Межклассовая Таутомерия Конформа- ционная
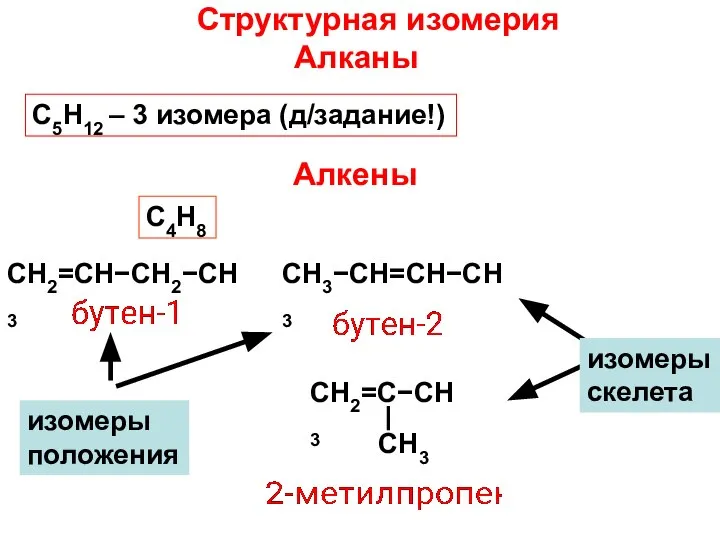
- 14. Структурная изомерия Алканы С5Н12 – 3 изомера (д/задание!) Алкены С4H8 СН2=СН−СН2−СН3 СН3−СН=СН−СН3 изомеры положения СН2=С−СН3 СН3
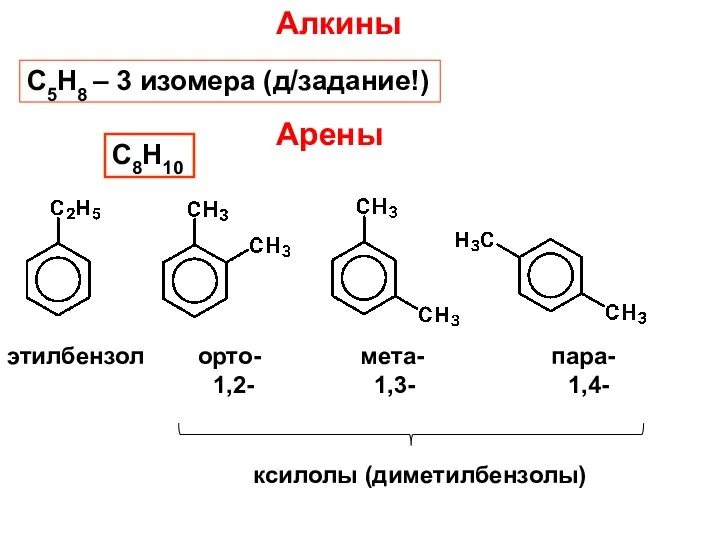
- 15. Арены этилбензол орто- мета- пара- 1,2- 1,3- 1,4- ксилолы (диметилбензолы) С8Н10 С5Н8 – 3 изомера (д/задание!)
- 16. Стереохимия – наука о пространственном строении молекул Конформация – произвольное расположе- ние атомов молекулы в пространстве
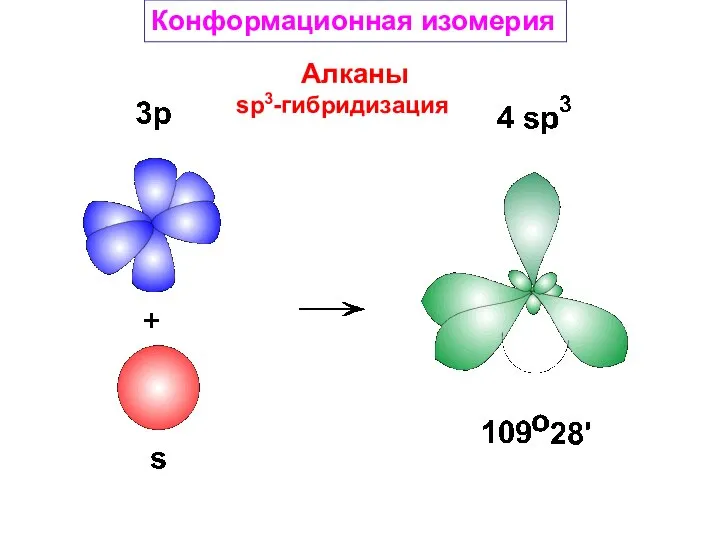
- 17. Алканы sp3-гибридизация Конформационная изомерия
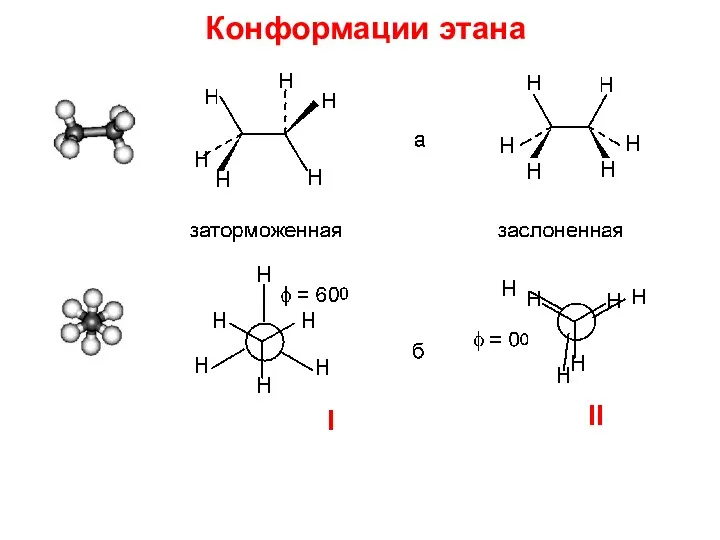
- 18. Конформации этана I II
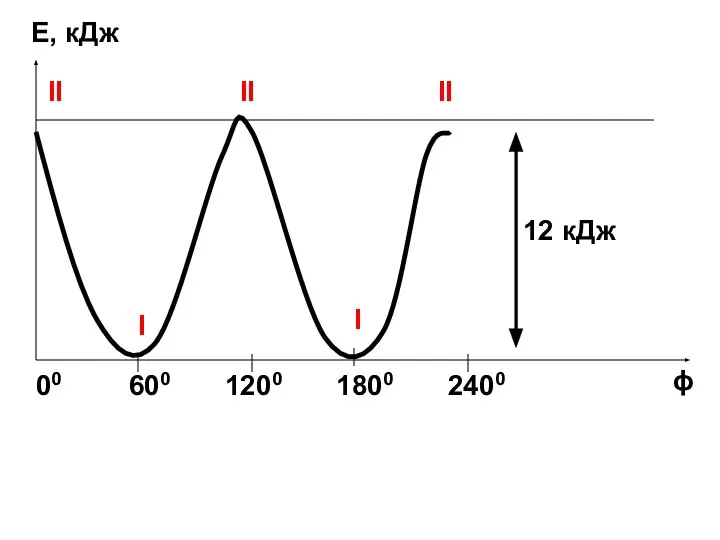
- 19. Е, кДж ϕ 00 600 1200 1800 2400 I I II II II 12 кДж
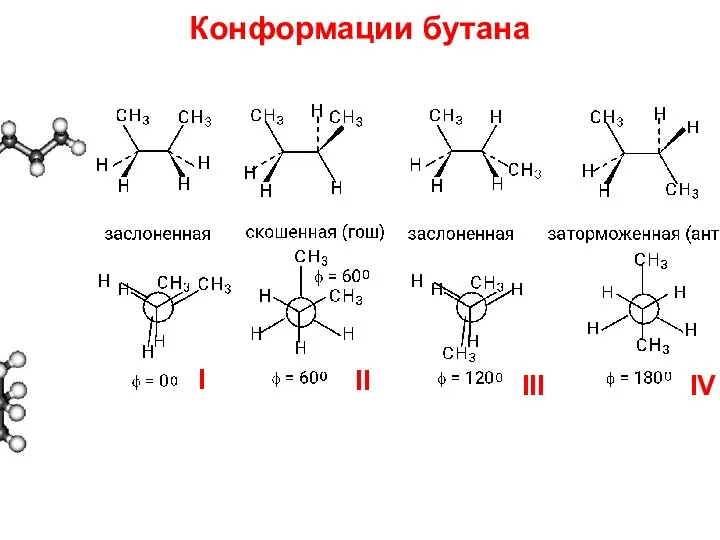
- 20. Конформации бутана I II III IV
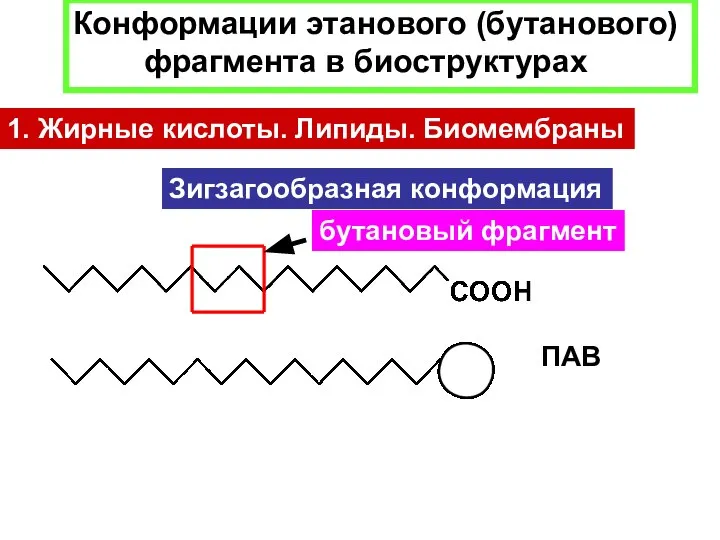
- 21. Зигзагообразная конформация бутановый фрагмент ПАВ Конформации этанового (бутанового) фрагмента в биоструктурах 1. Жирные кислоты. Липиды. Биомембраны
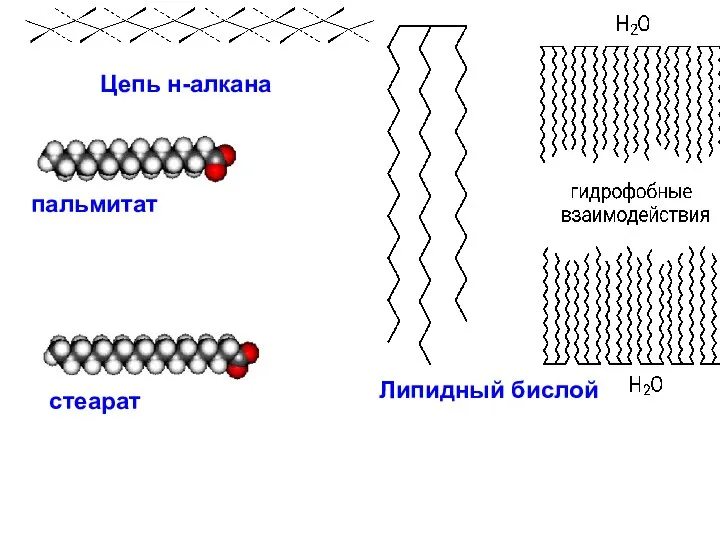
- 22. Липидный бислой стеарат пальмитат Цепь н-алкана
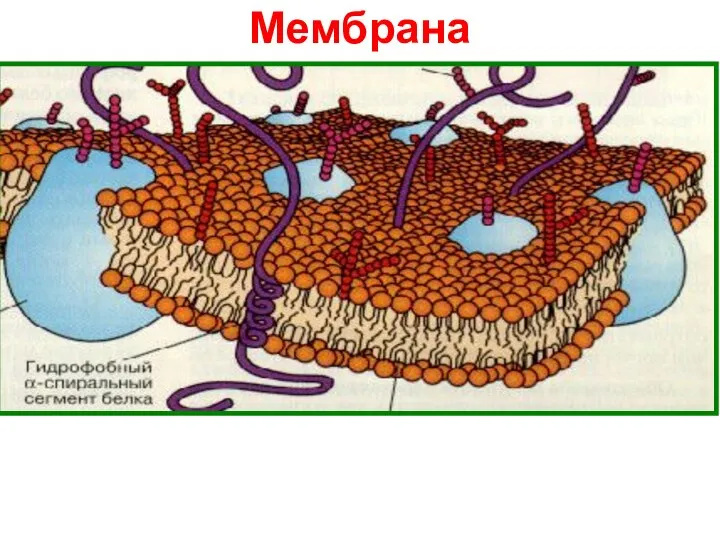
- 23. Мембрана
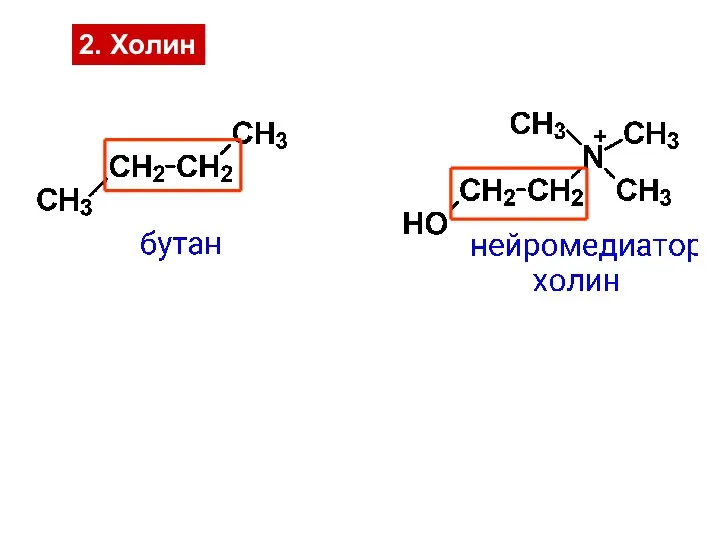
- 24. 2. Холин
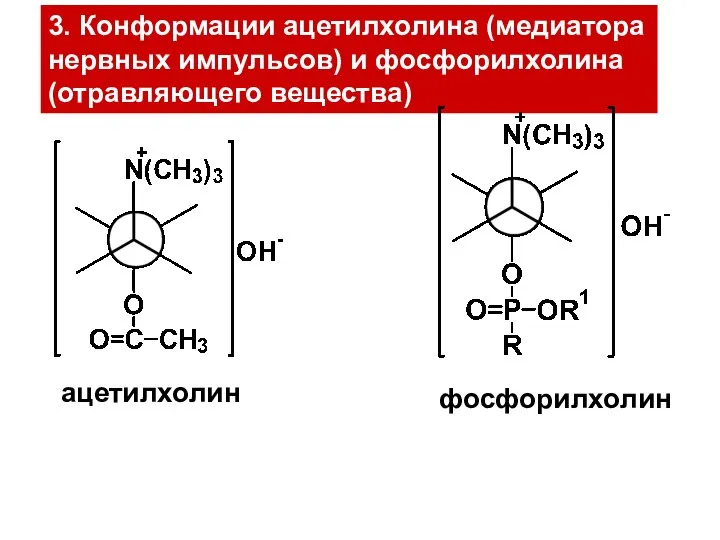
- 25. 3. Конформации ацетилхолина (медиатора нервных импульсов) и фосфорилхолина (отравляющего вещества) ацетилхолин фосфорилхолин
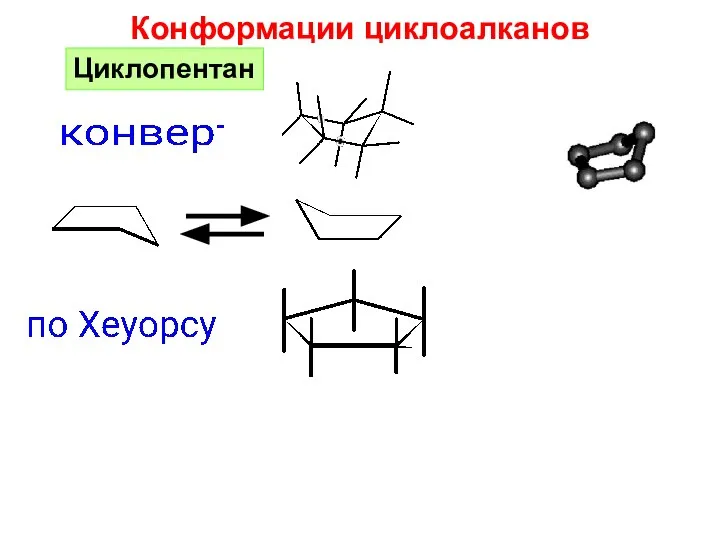
- 26. Конформации циклоалканов Циклопентан
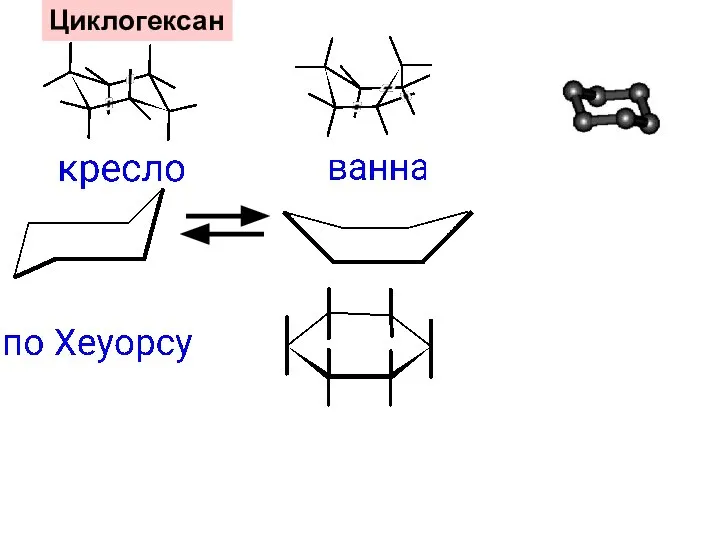
- 27. Циклогексан
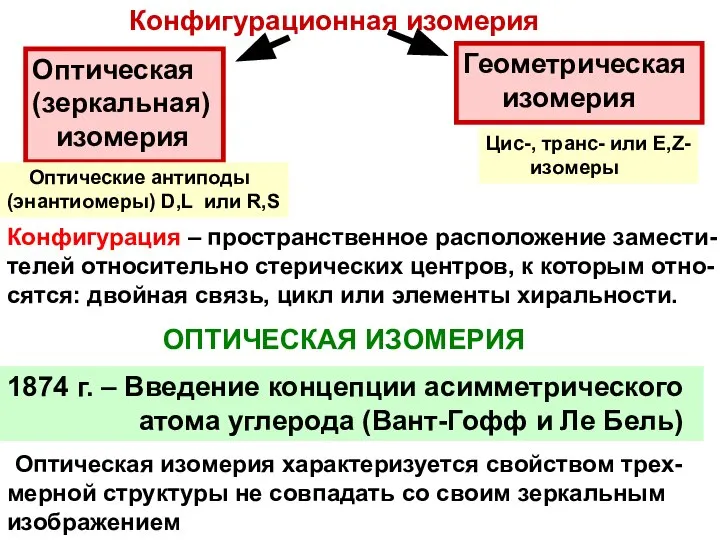
- 28. Конфигурационная изомерия Оптическая (зеркальная) изомерия Геометрическая изомерия ОПТИЧЕСКАЯ ИЗОМЕРИЯ 1874 г. – Введение концепции асимметрического атома
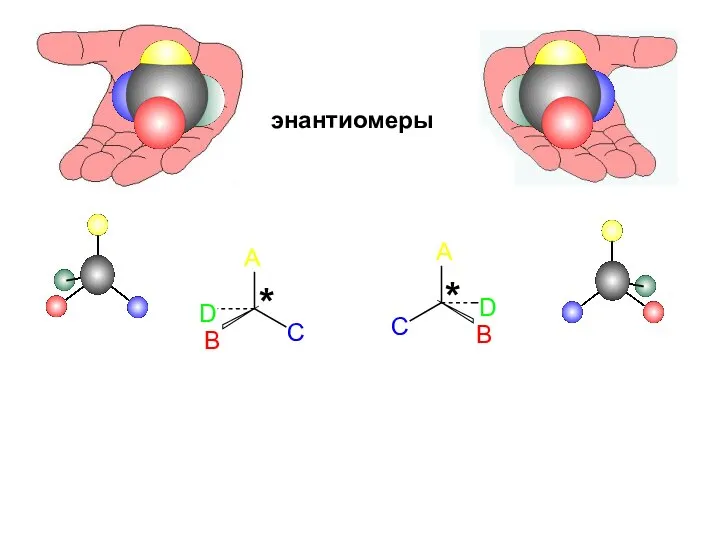
- 29. Такие структуры называются хиральными («хирос» - рука, хирургия – «рукоделие»). Простейший случай хиральности – наличие асимметрического
- 30. A B C D D C B A энантиомеры * *
- 31. Примеры энантиомеров: Две руки, две перчатки, два башмака, две спирали, два ключа с левой и правой
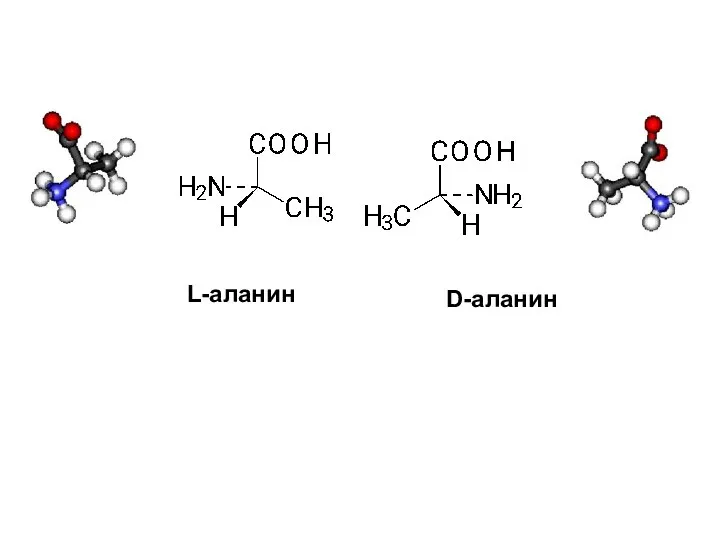
- 32. D-аланин L-аланин
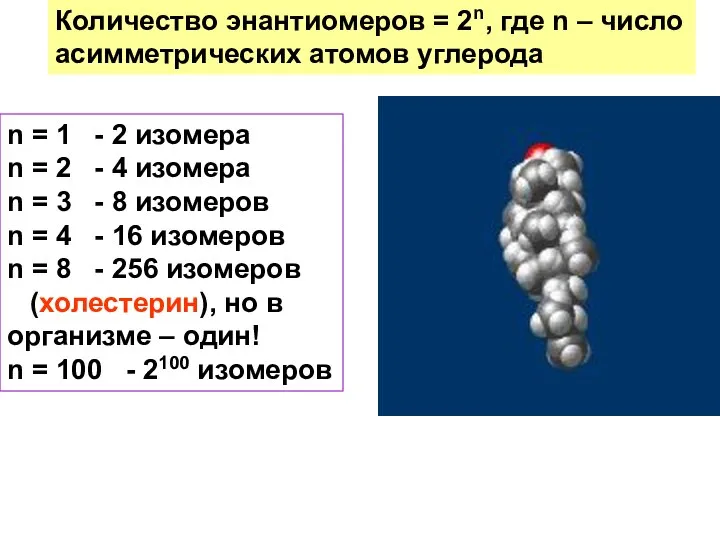
- 33. Количество энантиомеров = 2n, где n – число асимметрических атомов углерода n = 1 - 2
- 34. Свойства энантиомеров 1) Химические Энантиомеры идентичны в большинстве свойств, исключая те, что проявляются под влиянием асимметрических
- 35. Это свойство – оптическая активность. Измеряется с помощью приборов - поляриметров или спектрополяриметров Левовращающий изомер –
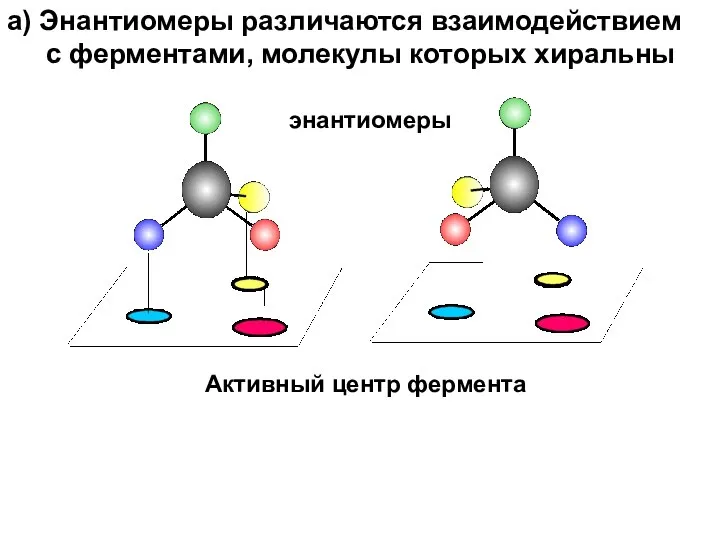
- 36. энантиомеры Активный центр фермента а) Энантиомеры различаются взаимодействием с ферментами, молекулы которых хиральны
- 37. (-)-сарколизин оказывает противоопухолевое действие, а (+)-изомер - неактивен и др. в) Вкус пищи (разный) связан с
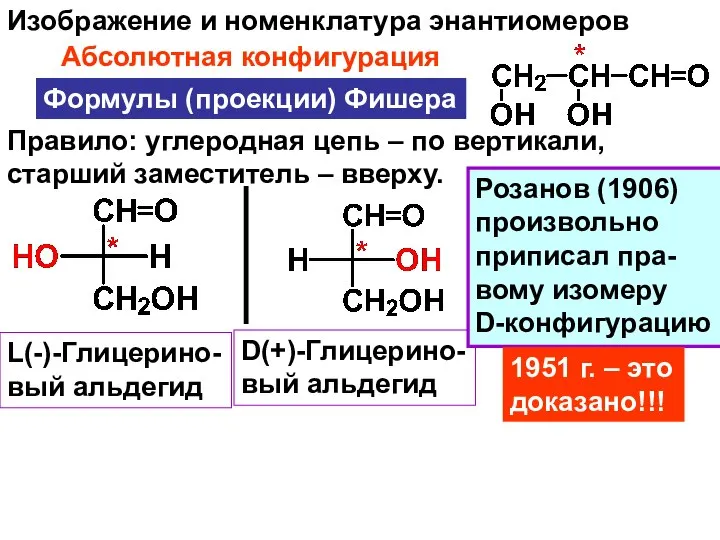
- 38. Изображение и номенклатура энантиомеров Формулы (проекции) Фишера Абсолютная конфигурация L(-)-Глицерино- вый альдегид D(+)-Глицерино- вый альдегид Правило:
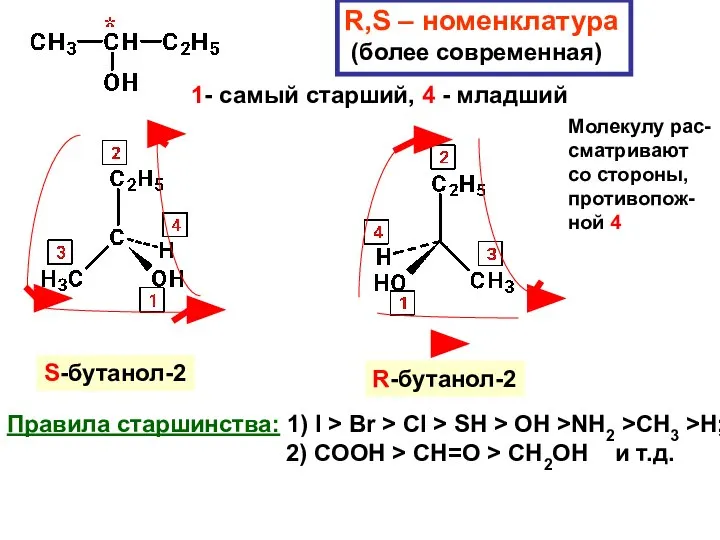
- 39. R,S – номенклатура (более современная) 1- самый старший, 4 - младший Молекулу рас- сматривают со стороны,
- 40. Диастереомеры – такие оптические изомеры, которые не являются энантиомерами (у них конфигурация одного асимметрического центра совпадает,
- 41. Причина существования геометрической изомерии – невозможность свободного вращения вокруг двойной связи или вокруг σ-связей, образующих цикл
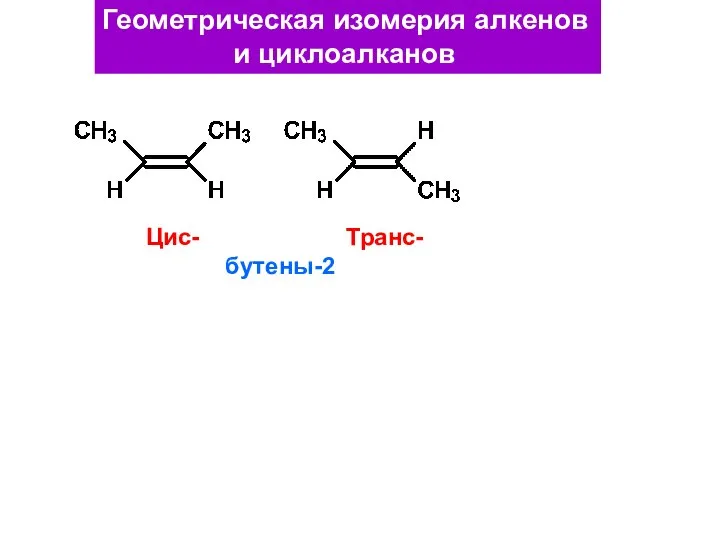
- 42. Геометрическая изомерия алкенов и циклоалканов Цис- Транс- бутены-2
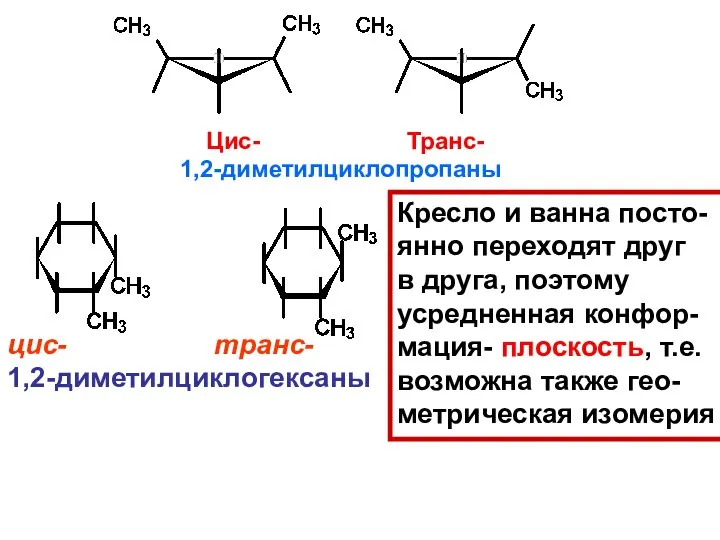
- 43. цис- транс- 1,2-диметилциклогексаны Кресло и ванна посто- янно переходят друг в друга, поэтому усредненная конфор- мация-
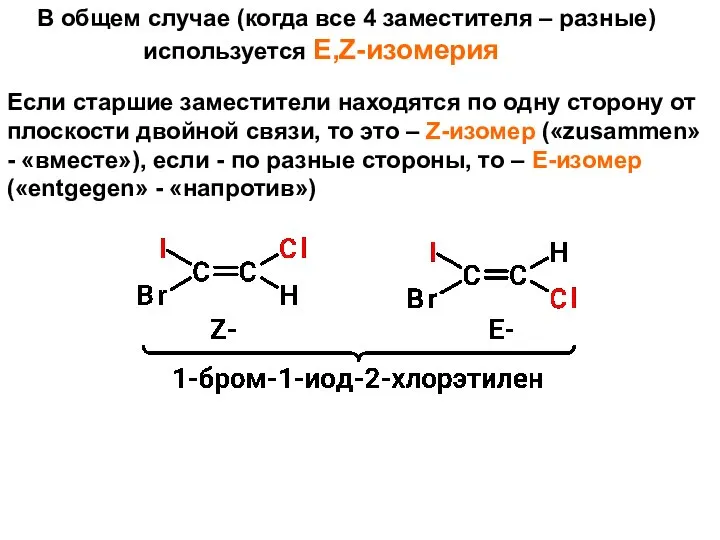
- 44. В общем случае (когда все 4 заместителя – разные) используется E,Z-изомерия Если старшие заместители находятся по
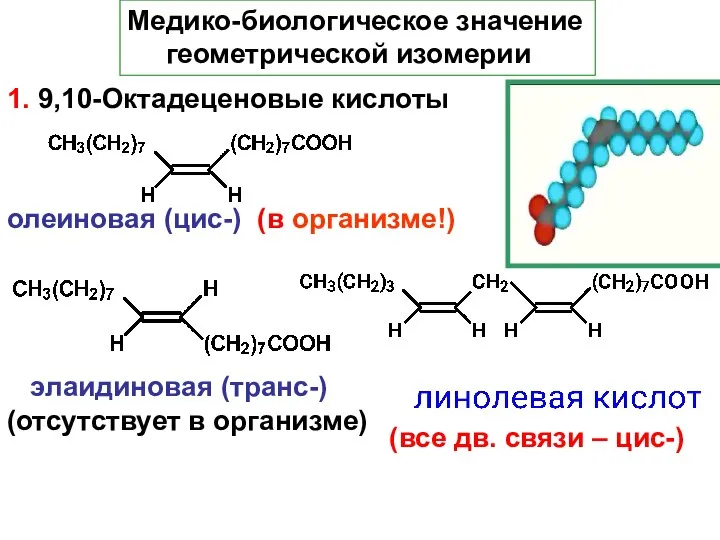
- 45. Медико-биологическое значение геометрической изомерии 1. 9,10-Октадеценовые кислоты олеиновая (цис-) (в организме!) элаидиновая (транс-) (отсутствует в организме)
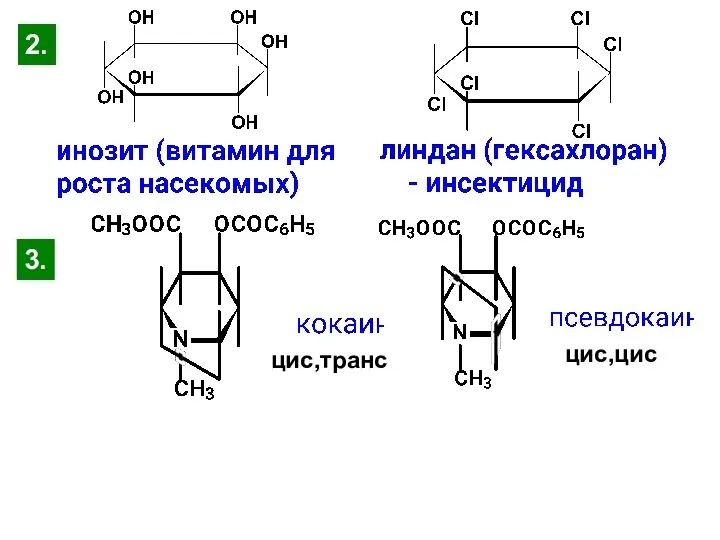
- 46. цис,цис цис,транс 2. 3.
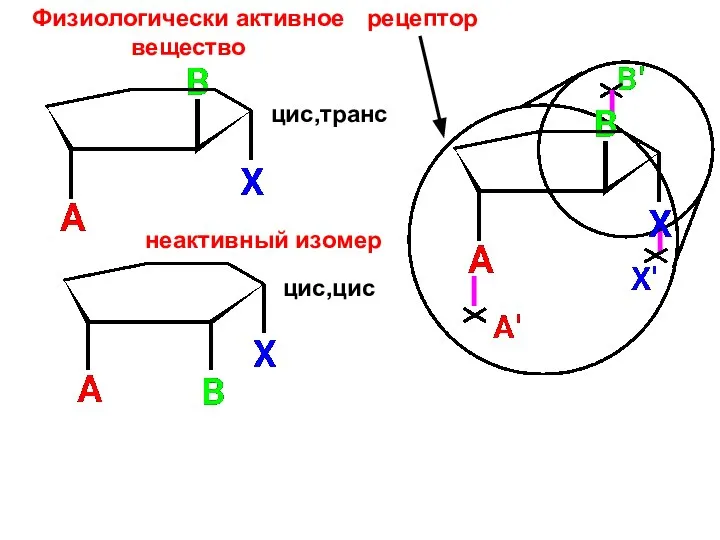
- 47. рецептор Физиологически активное вещество неактивный изомер цис,транс цис,цис
- 49. Скачать презентацию










 Филимоновская игрушка
Филимоновская игрушка Внешняя политика Российской империи во второй половине XVIII в. Автор – Александр Худобец Киев
Внешняя политика Российской империи во второй половине XVIII в. Автор – Александр Худобец Киев Презентация Таможенная процедура Экспорт
Презентация Таможенная процедура Экспорт Прикладное программное обеспечение
Прикладное программное обеспечение Природно-климатические условия местности в архитектурном проектировании
Природно-климатические условия местности в архитектурном проектировании Структура страницы для загрузки LADA Granta Cross
Структура страницы для загрузки LADA Granta Cross Уровни автоматизации управления предприятием
Уровни автоматизации управления предприятием Спортивный досуг для детей младшего дошкольного возраста «Вместе с мамой, вместе с папой»
Спортивный досуг для детей младшего дошкольного возраста «Вместе с мамой, вместе с папой» Виды рисков
Виды рисков США. Политика
США. Политика Der Laserlicht des BMW i8
Der Laserlicht des BMW i8 A Journey Through Implementing Multiscattering BRDFs and Area Lights
A Journey Through Implementing Multiscattering BRDFs and Area Lights Великие Физиологи
Великие Физиологи О готовности образовательных учреждений Павловского района к введению ФГОС НОО Митина Н.П. 23 марта 2011г.
О готовности образовательных учреждений Павловского района к введению ФГОС НОО Митина Н.П. 23 марта 2011г. Понятие и признаки гражданского правоотношения Подготовила: студентка 2-го курса ФТД, Группы Т094, Зайцева Виктория
Понятие и признаки гражданского правоотношения Подготовила: студентка 2-го курса ФТД, Группы Т094, Зайцева Виктория Учитель начальных классов ГОУ СОШ № 567 Гомолицкая Ирина Николаевна Санкт- Петербург Петродворцовый район
Учитель начальных классов ГОУ СОШ № 567 Гомолицкая Ирина Николаевна Санкт- Петербург Петродворцовый район Системная инженерия
Системная инженерия Решение задач нелинейного программирования (ЗНЛп) в пакете Excel
Решение задач нелинейного программирования (ЗНЛп) в пакете Excel Стероидные гормоны Гормоны
Стероидные гормоны Гормоны Новый год в Японии
Новый год в Японии КАФЕДРА НОРМАЛЬНОЙ ФИЗИОЛОГИИ КрасГМА ФИЗИОЛОГИЯ ВЫДЕЛЕНИЯ. ФИЗИОЛОГИЯ ПОЧЕК И ВОДНО-СОЛЕВОГО ОБМЕНА
КАФЕДРА НОРМАЛЬНОЙ ФИЗИОЛОГИИ КрасГМА ФИЗИОЛОГИЯ ВЫДЕЛЕНИЯ. ФИЗИОЛОГИЯ ПОЧЕК И ВОДНО-СОЛЕВОГО ОБМЕНА  Контрафактная продукция
Контрафактная продукция Как правильно составить резюме
Как правильно составить резюме Обобщенная структура процессора
Обобщенная структура процессора Повышение квалификации приходских специалистов в сфере катехизации взрослых
Повышение квалификации приходских специалистов в сфере катехизации взрослых Кровь как часть внутренней среды
Кровь как часть внутренней среды  Характеристика физической нагрузки и содержание её составляющих
Характеристика физической нагрузки и содержание её составляющих Кафедра теории и практики воспитания и дополнительного образования
Кафедра теории и практики воспитания и дополнительного образования