Содержание
- 2. 1. Миоглобин и гемоглобин. Гемоглобин: структура, свойства, виды, возрастные изменения качественного и количественного состава в крови.
- 3. 1. Миоглобин и гемоглобин. Гемоглобин: структура, свойства, виды, возрастные изменения качественного и количественного состава в крови.
- 4. К группе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система,
- 5. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином,
- 6. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного
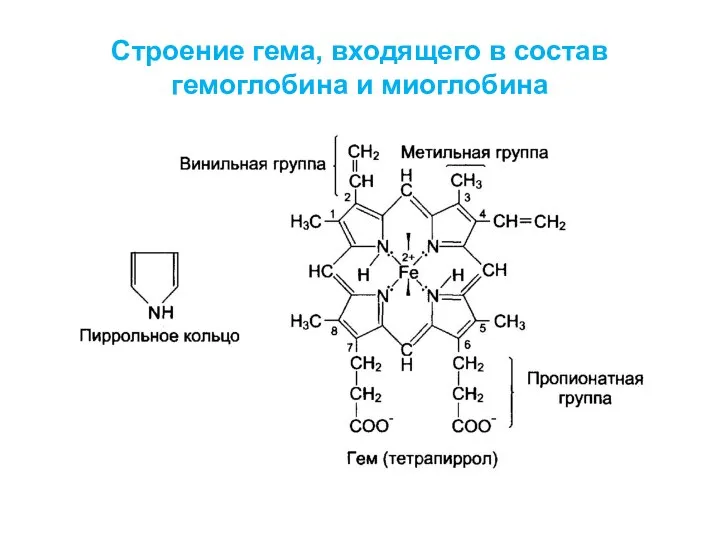
- 7. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные
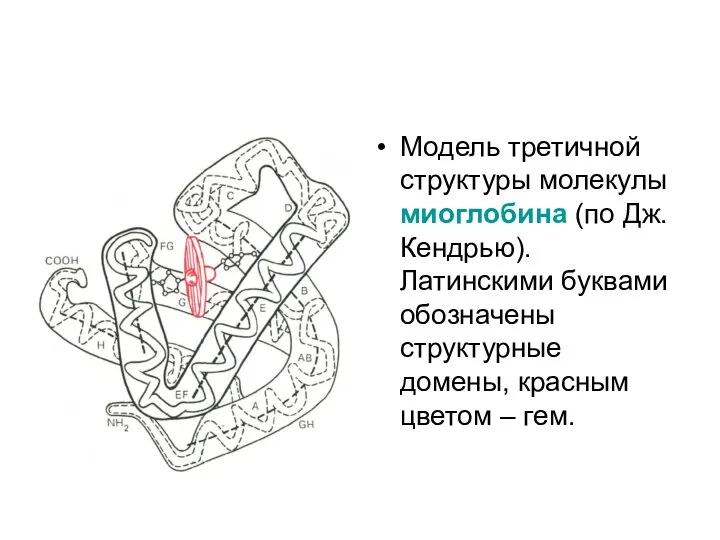
- 8. Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом –
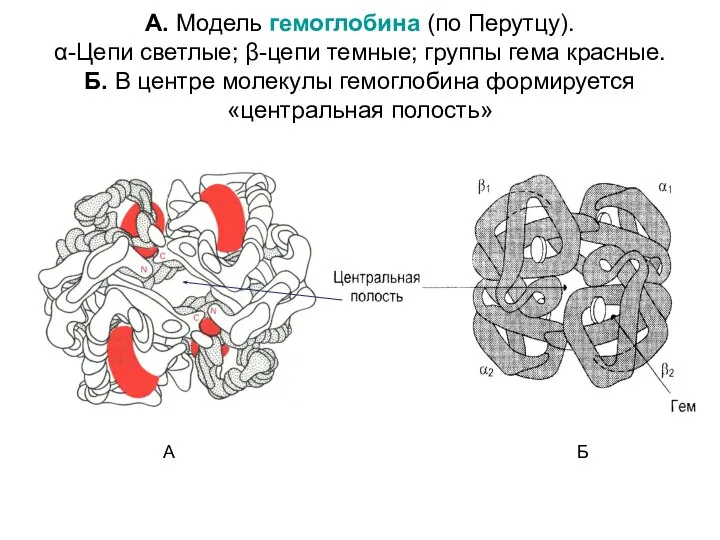
- 9. А. Модель гемоглобина (по Перутцу). α-Цепи светлые; β-цепи темные; группы гема красные. Б. В центре молекулы
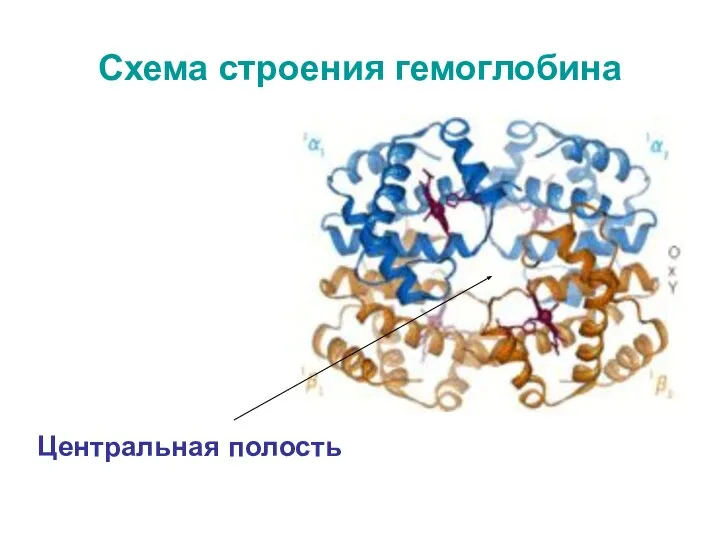
- 10. Схема строения гемоглобина Центральная полость
- 11. Строение гема, входящего в состав гемоглобина и миоглобина
- 12. Миоглобин – содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы,
- 13. Гемоглобины – структурно-родственные белки, находящиеся в эритроцитах позвоночных. Они выполняют две важные биологические функции: 1) переносят
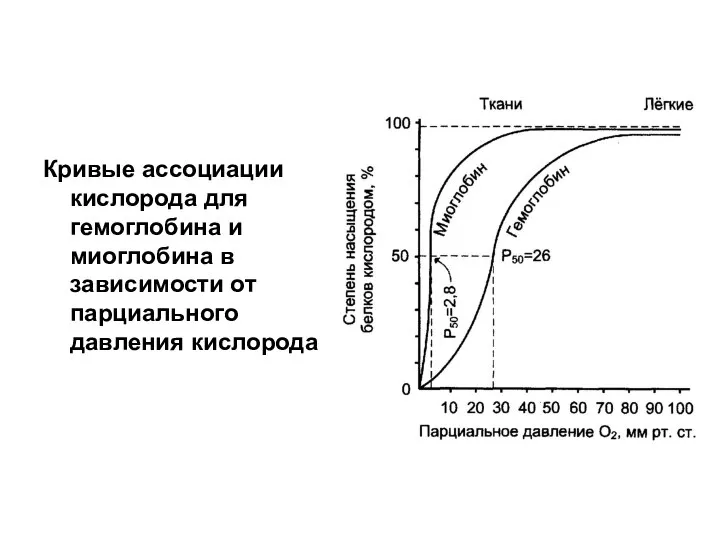
- 14. Кривые ассоциации кислорода для гемоглобина и миоглобина в зависимости от парциального давления кислорода
- 15. Наиболее распространенные гемоглобины имеют следующую тетрамерную структуру: НЬА (нормальный гемоглобин взрослого человека) – α2β2. Это основной
- 16. 2. Производные гемоглобина. Аномальные гемоглобины. Серповидно-клеточная анемия и талассемия
- 17. Мутантные (М) гемоглобины человека Мутации генов, кодирующих α- и β-цепи, могут существенным образом сказываться на их
- 18. Гемоглобин при серповидноклеточной анемии В гемоглобине S остаток Glu A2(6)β замещен на Val. Остаток А2 (Glu
- 19. Различия в строении молекул гемоглобинов 1 2 3 4 5 6 7 8 Hb A: Вал-Гис-Лей-Тре-Про-Глу-Глу-Лиз…
- 20. Этот липкий участок присутствует как в оксигенированном, так и в дезоксигенированном гемоглобине S (в гемоглобине А
- 21. Когда гемоглобин S переходит в дезоксигенированное состояние, его липкий участок связывается с комплементарным участком на другой
- 22. Ассоциация молекул дезоксигемоглобина S
- 23. Другая важная группа нарушений, связанных с аномалиями гемоглобина – талассемии. Для них характерна пониженная скорость синтеза
- 24. 3. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3–бисфосфоглицерата
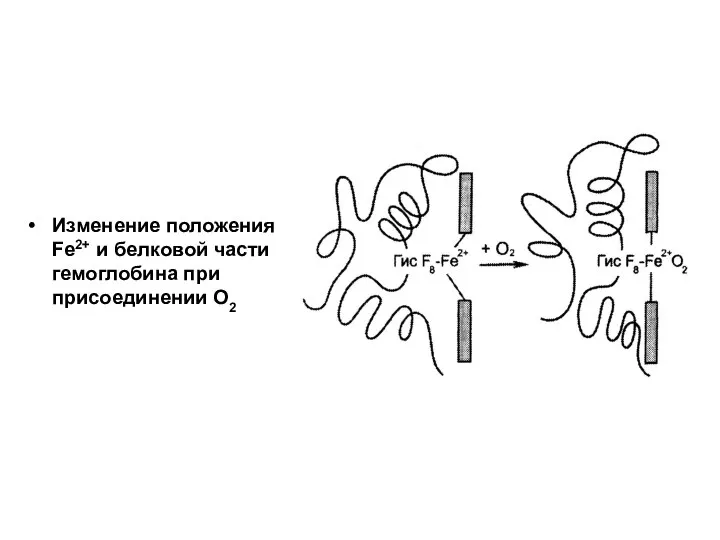
- 25. Кооперативные изменения конформации гемоглобина В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из
- 26. Изменение положения Fe2+ и белковой части гемоглобина при присоединении О2
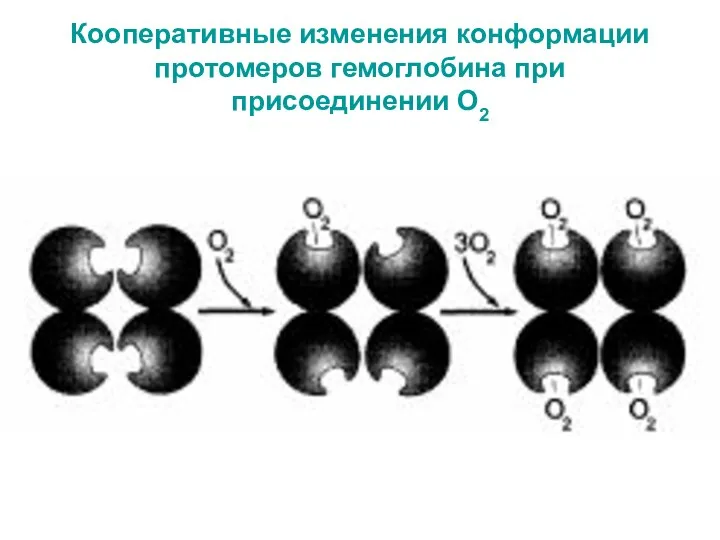
- 27. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2
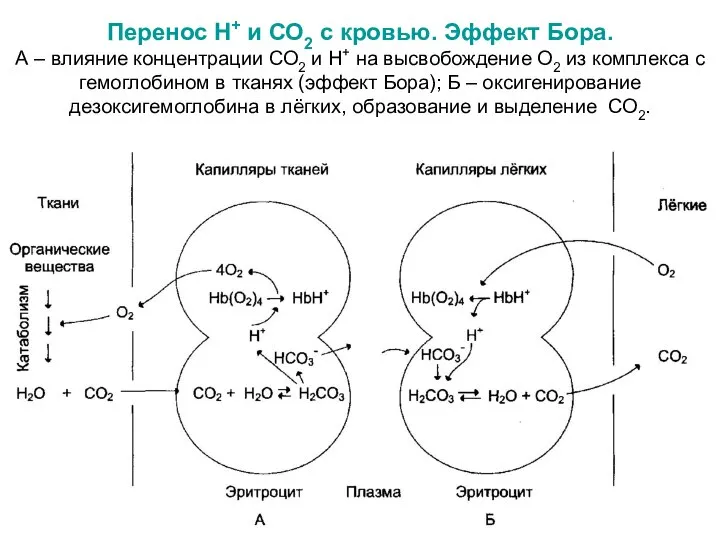
- 28. Перенос Н+ и СО2 с кровью. Эффект Бора. А – влияние концентрации СО2 и Н+ на
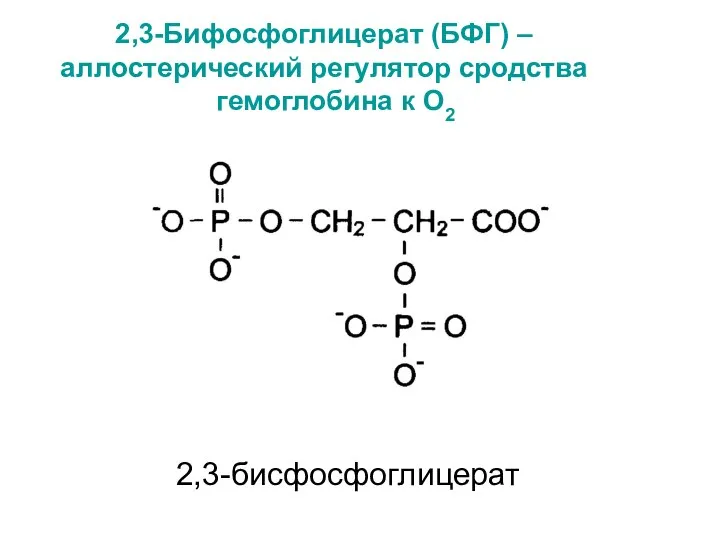
- 29. 2,3-Бифосфоглицерат (БФГ) – аллостерический регулятор сродства гемоглобина к О2 2,3-бисфосфоглицерат
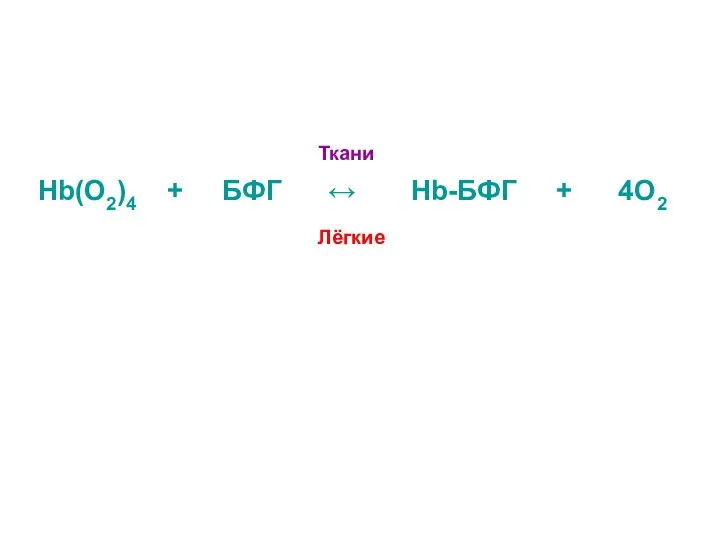
- 30. Ткани Нb(О2)4 + БФГ ↔ Нb-БФГ + 4О2 Лёгкие
- 31. 4. Роль протеомики в оценке патологических состояний. Понятие об азотистом балансе. Переваривание и всасывание пищевых белков.
- 32. Протеомика – наука, основным предметом изучения которой являются белки, их функции и взаимодействия в живых организмах,
- 33. Основная задача протеомики – количественный анализ экспрессии белков в клетках в зависимости от их типа, состояния
- 34. Азотистый баланс означает разность между общим количеством азота, поступившим в организм человека (или другой организм), и
- 35. Если азота поступает больше, чем экскретируется, говорят, что данный индивидуум имеет положительный азотистый баланс. Примеры: период
- 36. Взрослый человек в норме находится в состоянии азотистого равновесия: потребление азота уравновешивается его выделением в составе
- 37. В состоянии отрицательного азотистого баланса количество выделяемого азота превышает количество азота, потребляемого организмом. Важным примером служат
- 38. Переваривание пищевых белков Переваривание белков, входящих в состав пищи, происходит в различных отделах ЖКТ с участием
- 39. Пепсин Основная пищеварительная функция желудка заключается в том, что в нем начинается переваривание белка. Пепсин продуцируется
- 40. Пепсин преобразует денатурированный белок в протеозы и затем в пептоны —большие полипептидные производные. Он представляет собой
- 41. Гастриксин – протеолитический фермент (катализирующий расщепление белка пищи) желудочного сока, проявляющий максимальную активность при pH, равном
- 42. Гастриксин, в отличие от пепсина, протеолетически активен в менее кислой среде. Гастриксин является вторым по объёму
- 43. Реннин (химозин, сычужный фермент). Этот фермент вызывает створаживание молока. Он чрезвычайно важен для процессов пищеварения у
- 44. Трипсин, химотрипсин и эластаза Протеолитическое действие панкреатического секрета обусловливается тремя эндопептидазами – трипсином, химотрипсином и эластазой,
- 45. Все три фермента секретируются в виде зимогенов. Активация трипсиногена осуществляется другим протеолитическим ферментом, энтерокиназой, секретируемой слизистой
- 46. Карбоксипептидаза Дальнейшее расщепление полипептидов, образовавшихся под действием эндопептидаз, осуществляет экзопептидаза – карбоксипептидаза, которая атакует С-концевую пептидную
- 47. Переваривание секретом кишечника Кишечный сок, секретируемый железами Бруннера и Либеркюна, также содержит пищеварительные ферменты, в число
- 48. Переваривание секретом кишечника 3) фосфатаза, удаляющая фосфат из некоторых органических фосфатов (гексозофосфаты и глицерофосфат) и из
- 49. Всасывание аминокислот и белка В нормальных условиях пищевые белки почти полностью расщепляются на составляющие их аминокислоты,
- 50. Изменения белкового состава организма Изменение белкового состава клеток в процессе их дифференцировки. Наследственные протеинопатии. Приобретённые протеинопатии.
- 51. 5. Бактериальное расщепление невсосавшихся в кишечнике аминокислот
- 52. Процессы гниения и брожения в кишечнике Большая часть потребленной пищи всасывается в тонком кишечнике. Остальная часть
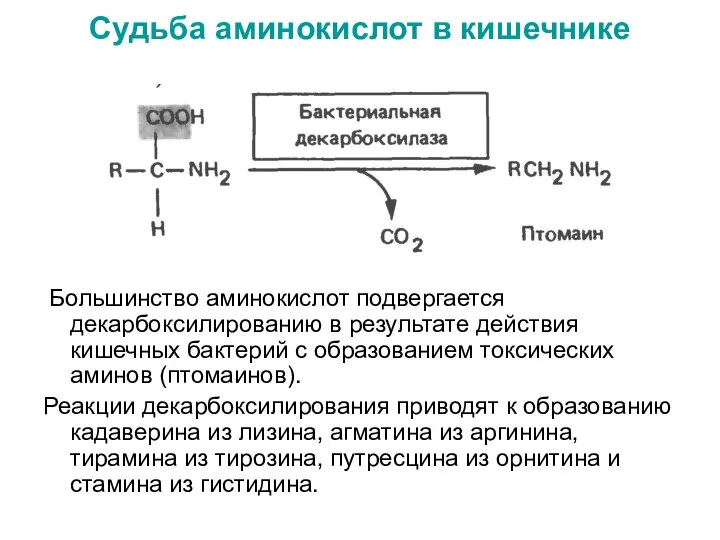
- 53. Судьба аминокислот в кишечнике Большинство аминокислот подвергается декарбоксилированию в результате действия кишечных бактерий с образованием токсических
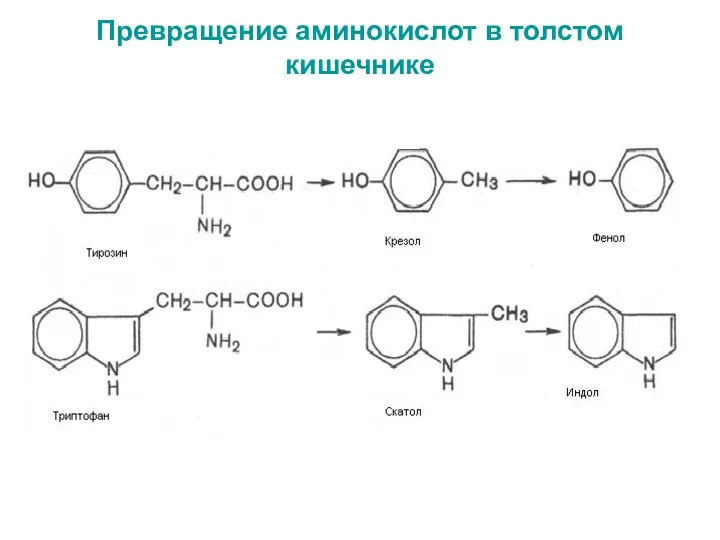
- 54. [2H] CH3SH → CH4 + H2S Метилмеркаптан Метан Сероводород Аминокислота триптофан в результате нескольких реакций превращается
- 55. Превращение аминокислот в толстом кишечнике
- 57. Скачать презентацию









































![[2H] CH3SH → CH4 + H2S Метилмеркаптан Метан Сероводород Аминокислота триптофан](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/749528/slide-53.jpg)
 Белый медведь Кулькова Ольга
Белый медведь Кулькова Ольга Основные методы селекции животных
Основные методы селекции животных Понятие о природном сообществе, биогеоценозе и экосистеме. Приспособленность растений к совместной жизни в природном сообществе
Понятие о природном сообществе, биогеоценозе и экосистеме. Приспособленность растений к совместной жизни в природном сообществе ДНК. РНК. АТФ
ДНК. РНК. АТФ Генетика человека
Генетика человека Сенсорные возможности животных
Сенсорные возможности животных Муниципальное бюджетное образовательное учреждение Средняя общеобразовательная школа № 121 .. «ПОЧЕМУ ЖИВЫЕ ОРГАНИЗМЫ НЕ РАС
Муниципальное бюджетное образовательное учреждение Средняя общеобразовательная школа № 121 .. «ПОЧЕМУ ЖИВЫЕ ОРГАНИЗМЫ НЕ РАС Императорские пингвины
Императорские пингвины  Обитатели садов и огородов
Обитатели садов и огородов Плесневые грибы и дрожжи
Плесневые грибы и дрожжи Способы питания животных.
Способы питания животных. Особенности морфологии и строения других групп микроорганизмов
Особенности морфологии и строения других групп микроорганизмов Африканская саванна
Африканская саванна Высшая нервная деятельность
Высшая нервная деятельность Выявления факторов, ограничивающих рост и развитие растений
Выявления факторов, ограничивающих рост и развитие растений Экологические группы гидробионтов.
Экологические группы гидробионтов. Урок-игра по теме: «Путешествие по эукариотической клетке» Разработала учитель биологии МОУ СОШ №18 Города Костромы Рыбкина На
Урок-игра по теме: «Путешествие по эукариотической клетке» Разработала учитель биологии МОУ СОШ №18 Города Костромы Рыбкина На Оленячі роги та їхне застосування
Оленячі роги та їхне застосування Лабораторная работа «Одноклеточные и многоклеточные организмы под микроскопом»
Лабораторная работа «Одноклеточные и многоклеточные организмы под микроскопом» Исследовательский проект Кактус – колючий друг
Исследовательский проект Кактус – колючий друг Социально-биологические основы физической культуры
Социально-биологические основы физической культуры растения поля
растения поля ПОНЯТИЕ О КЛЕТКЕ
ПОНЯТИЕ О КЛЕТКЕ Критерий согласия. Практический пример применения критерия согласия. Закон Менделя
Критерий согласия. Практический пример применения критерия согласия. Закон Менделя Уссурийские тигры. Научно-практическая конференция Взгляд в будущее-2017. Проект их жизнь в наших руках
Уссурийские тигры. Научно-практическая конференция Взгляд в будущее-2017. Проект их жизнь в наших руках Презентация на тему Строение и функции пищеварительной системы
Презентация на тему Строение и функции пищеварительной системы Флора и Фауна Кубани.
Флора и Фауна Кубани. Фізіологія збудливих тканин
Фізіологія збудливих тканин