Содержание
- 2. Цели урока: Рассмотреть строение молекулы аммиака и солей аммония; Познакомиться с физическими свойствами, способами получения, распознавания
- 3. Строение молекулы аммиака Электронная формула: Структурная формула: H N H H
- 4. Физические свойства аммиака: Аммиак NH3 – газ без цвета, с резким запахом, почти в два раза
- 5. Химические свойства аммиака C водой: NH3 + H2O NH3 * H2O С кислотами: Горит : NH3
- 6. Получение и распознавание аммиака В промышленности: N2 + H2 NH3 В лаборатории: Ca(OH)2 + NH4CL =
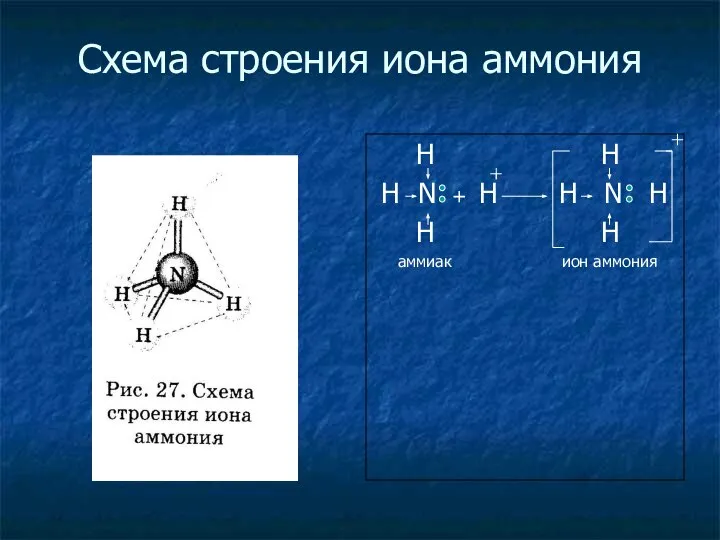
- 7. Схема строения иона аммония H H H N + H H N H H H аммиак
- 8. Соли аммония Сложные вещества, состоящие из катионов аммония и анионов кислотного остатка По физическим свойствам похожи
- 10. Скачать презентацию






 Аммофос өндірісі. Алыну әдісі
Аммофос өндірісі. Алыну әдісі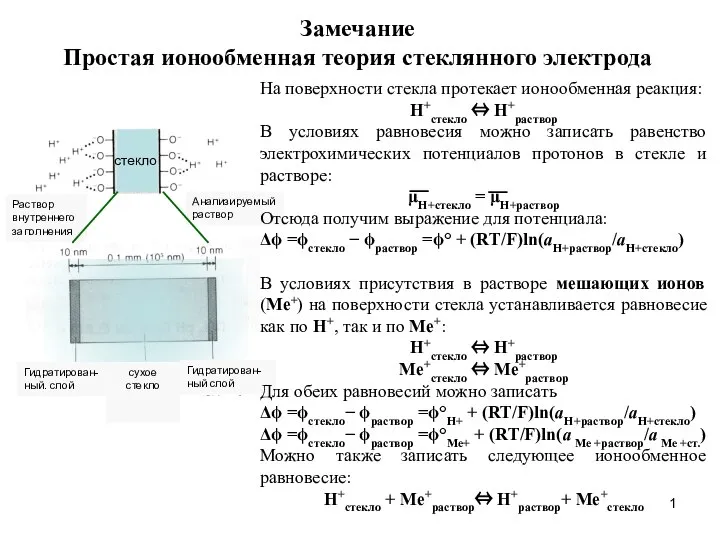 Простая ионообменная теория стеклянного электрода
Простая ионообменная теория стеклянного электрода Марганец. Роль марганца в организме
Марганец. Роль марганца в организме Решение задач Скорость химических реакций 11 класс
Решение задач Скорость химических реакций 11 класс  Парниковий ефект
Парниковий ефект Презентация по Химии "Соли в медицине" - скачать смотреть
Презентация по Химии "Соли в медицине" - скачать смотреть  Сероводоро́д, сернистый водород (H2S) (физические свойства)
Сероводоро́д, сернистый водород (H2S) (физические свойства) Определение содержания солей в нефти
Определение содержания солей в нефти Понятие о химической реакции. Реакции без изменения состава веществ
Понятие о химической реакции. Реакции без изменения состава веществ Формы кристаллов и агрегаты
Формы кристаллов и агрегаты Алкены
Алкены Непредельные углеводороды. Алкены. 9 класс
Непредельные углеводороды. Алкены. 9 класс Периодический закон и периодическая система химических элементов (турнир знатоков химии)
Периодический закон и периодическая система химических элементов (турнир знатоков химии) Тема урока: Силикатная промышленность
Тема урока: Силикатная промышленность Типы химической связи
Типы химической связи Современные конструкционные материалы
Современные конструкционные материалы Коллигативные свойства растворов
Коллигативные свойства растворов Свойства солей
Свойства солей Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4)
Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4) Диоксины, глобальные экотоксиканты
Диоксины, глобальные экотоксиканты Кинетика гетерогенно-каталитических реакций. (Лекция 22)
Кинетика гетерогенно-каталитических реакций. (Лекция 22) Духи
Духи Углеводы. Классификация углеводов
Углеводы. Классификация углеводов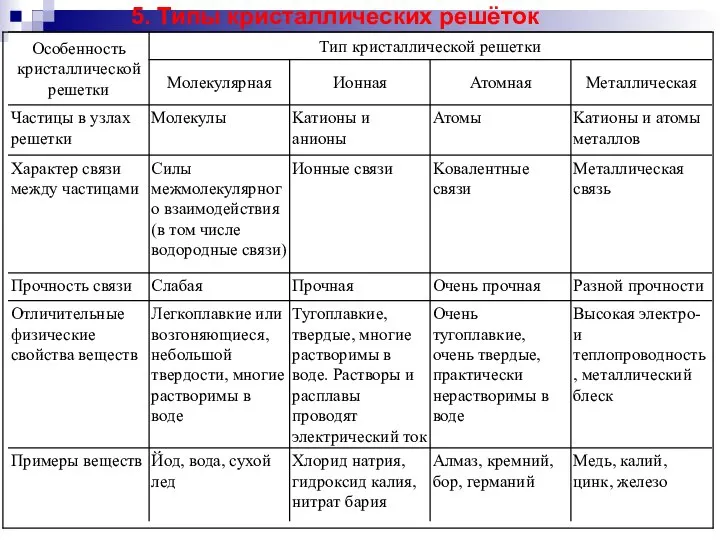 Типы кристаллических решёток. (Лекция 3)
Типы кристаллических решёток. (Лекция 3) Синтетические топлива
Синтетические топлива Основы органической химии. Кислородсодержащие органические соединения
Основы органической химии. Кислородсодержащие органические соединения Биохимия. Химический состав организма
Биохимия. Химический состав организма Углеводороды Выполнили Филаткина Ирина, Филаткина Марина ученица 11 класса МОБУ СОШ № 7 ЛГО
Углеводороды Выполнили Филаткина Ирина, Филаткина Марина ученица 11 класса МОБУ СОШ № 7 ЛГО