Содержание
- 2. Р – элементы IV группы C Si Ge Sn Pb
- 3. Аллотропные состояния углерода Графит Алмаз Фуллерены Сажа ( аморфные формы )
- 5. А л м а з
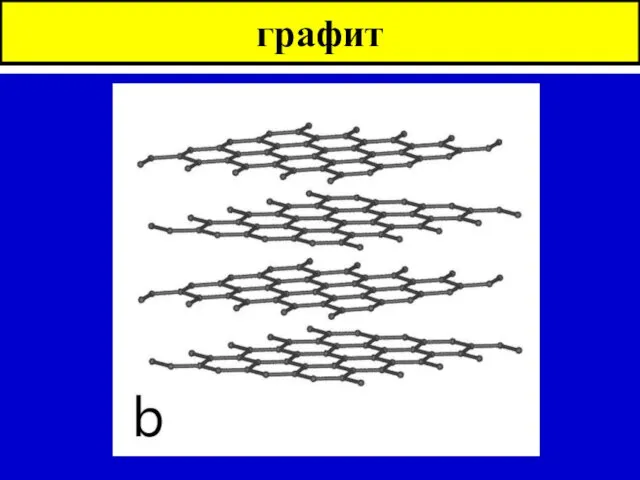
- 6. графит
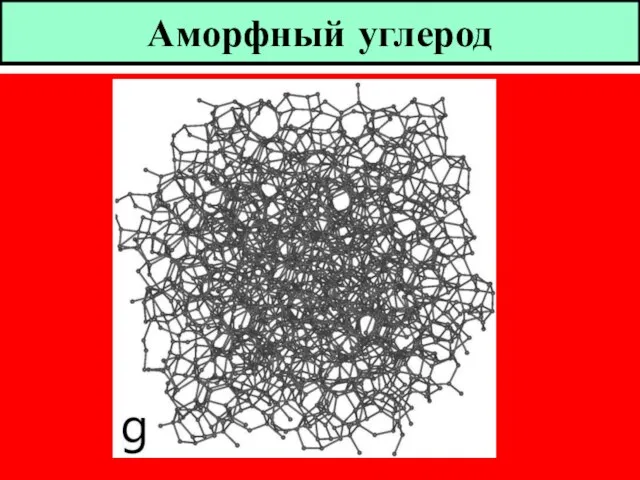
- 7. Аморфный углерод
- 8. Фуллерен С60
- 9. Аллотропные формы углерода Фуллерен С60
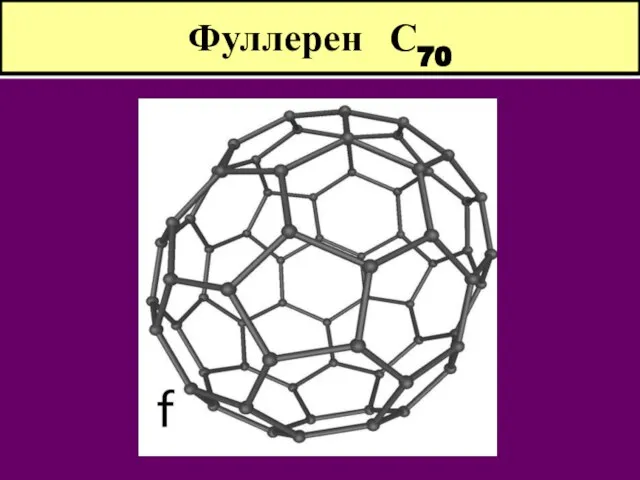
- 10. Фуллерен С70
- 11. Фуллерен С 540
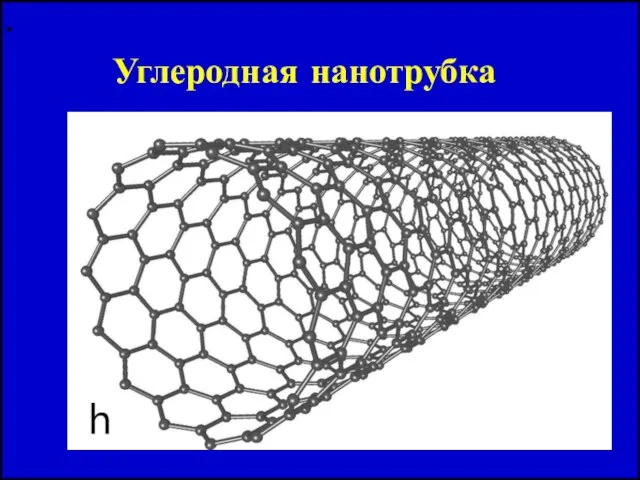
- 12. Углеродная нанотрубка
- 13. Электронные конфигурации, основные степени окисления C Si Ge Sn Pb -4 +2 +4 -4 +2 +4
- 14. Обзор свойств р – элементов IV группы Реакционная способность элементов возрастает сверху вниз по группе Все
- 15. Обзор свойств р–элементов IV группы Sn, Pb – соединения с вкладом ионного характера связи С обладает
- 16. Устойчивость соединений со связями С – С и Si - Si Соединения со связями С -
- 17. Гибридизация орбиталей атомов углерода Тип гибридизации зависит от кратности связи С – С : Одинарные С
- 18. Гибридизация орбиталей атомов углерода Двойные С = С связи – sp2 гибридные орбитали ( плоский треугольник
- 19. Оксиды р - элементов IV группы Монооксиды : CO SiO GeO SnO PbO амфотерные Устойчивость увеличивается
- 20. Оксиды р - элементов IV группы Смешанные оксиды : Pb2O3 [ PbO, PbO2 ] Pb2+ (Pb4+O3)
- 21. Гидриды р - элементов IV группы Углеводороды : СnH2n+2 Кремневодороды : SinH2n+2 Простейшие гидриды : CH4
- 22. Монооксид углерода СО Способы получения : Ств. раскал. + СО2(г) 2CO (г) Равновесие устанавливается быстро при
- 23. Монооксид углерода СО Конверсия природного газа : СН4 + Н2О = « СО + 3Н2 »
- 24. Монооксид углерода СО СО2(г) + Н2(г) = СО(г) + Н2О Лабораторный способ : каталитическое разложение муравьиной
- 25. Свойства монооксида СО СО - несолеобразующий оксид Однако : NaOH + CO ( 10 атм., 1500С
- 26. Свойства монооксида СО В молекуле С = О трехкратная связь Есв.= 265 ккал / моль СО
- 27. Свойства СО в качестве лиганда СО – слабый σ - донор ( за счет пары электронов
- 28. Свойства СО в качестве лиганда В результате связь в С≡О ослабляется, что проявляется снижением колебательных частот
- 29. Связь 3-х кратная, Есв. = 256 кДж/м, Y( CΞO ) = 2300 cм-1 АО МО АО
- 30. Y(СΞО) = 2000 см-1 М - СО АО МО АО 2р 2р С СО О π*
- 31. Примеры карбонильных комплексов [ Cr(CO)6 ] [ (CO)5Mn – Mn(CO)5 ] [ Fe(CO)5 ] [ (CO)4Co
- 32. Диоксид углерода СО2 Структура линейная [ O = C = O ] ( sp - гибрид.
- 33. Основные свойства СО32- - иона 0.1М р-р Na2CO3 рН = ? СО32- + Н2О НСО31- +
- 34. Карбиды Солеобразные карбиды : ацетилениды : М2С2 – ( М - щелочной металл ) МС2 –
- 35. Карбиды Метаниды : Be2C Al4C3 и др. Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
- 36. Карбиды Ковалентные гидриды : SiC B4C и другие Эти соединения обладают высокой твердостью и тугоплавкостью
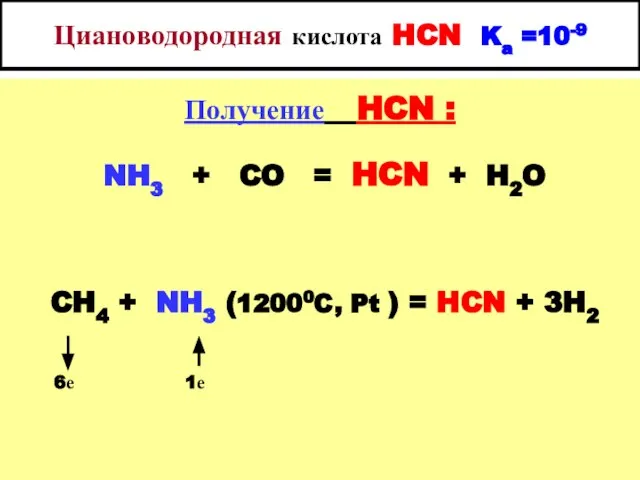
- 37. Циановодородная кислота HCN Ka =10-9 Получение HCN : NH3 + CO = HCN + H2O CH4
- 38. Циановодородная кислота HCN Ka =10-9 Получение HCN : 2CH4 + 3O2 + 2NH3 ( 8000C, Pt
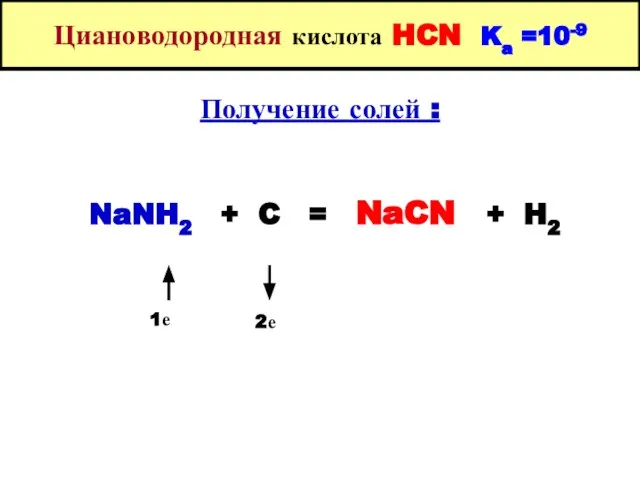
- 39. Циановодородная кислота HCN Ka =10-9 Получение солей : NaNH2 + C = NaCN + H2 1е
- 40. Циановодородная кислота HCN Ka =10-9 Получение солей : CaC2 + N2 (11000C) = CaCN2 + 2
- 41. Свойства HCN Ka = 10-9 Таутомерное равновесие H - C ≡ N H - N =
- 42. Свойства CN1- - иона как основания 0.1М раствор KCN рН = ? CN1- + H2O HCN
- 43. Цианид - ион в качестве лиганда ( - ) ( + ) [ : C N
- 44. Связь 3 - х кратная, Есв. = 256 кДж/м, Y( CΞO ) = 2300 cм-1 АО
- 45. Y(С Ξ О) = 2000 см-1 М - СО АО МО АО 2р 2р С СО
- 46. Цианид – ион CN1- Y(C Ξ N) = 2250 cм-1 АО МО АО 2р 2р С
- 47. Y(С Ξ N) = 2050 cм-1 М - CN АО МО АО 2р 2р С СN1-
- 48. Примеры цианидных комплексов [ Ag(CN)3 ] 2- β3 = 1021 [ Au(CN)2 ]1- β2 = 1038
- 49. Дициан (CN)2 [ N ≡ C – C ≡ N ] Получение : 2AgCN нагрев. =
- 50. Дициан (CN)2 [ N ≡ C – C ≡ N ] Получение : Cu2+ + 2CN1-
- 51. Дициан (CN)2 [ N ≡ C – C ≡ N ] Электродуговой разряд между графитовыми электродами
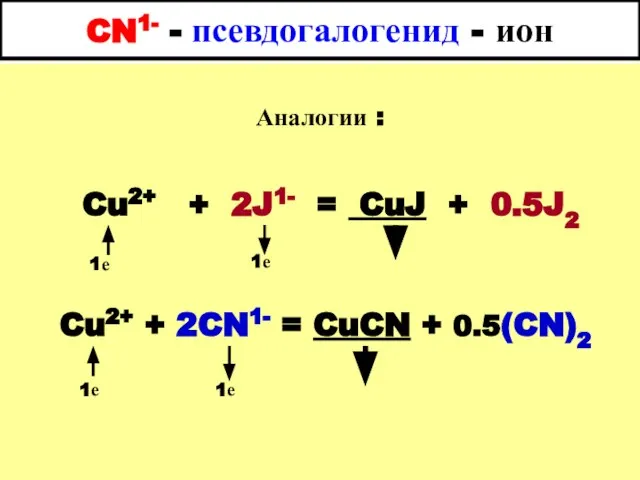
- 52. CN1- - псевдогалогенид - ион Аналогии : HgJ2 нагрев. = Hg + J2 Hg(CN)2 нагрев. =
- 53. CN1- - псевдогалогенид - ион Аналогии : CI2 + 2NaOH = NaCI + NaCIO + H2O
- 54. CN1- - псевдогалогенид - ион Аналогии : Cu2+ + 2J1- = CuJ + 0.5J2 Cu2+ +
- 55. Циановая кислота HCNO Ka = 10-4 Диспропорционирование : (CN)2 + 2NaOH = NaCN + NaCNO Ox
- 56. Циановая кислота HCNO Ka = 10-4 Три изомерные формы HCNO : H – O - C
- 57. Тиоциановая кислота HCNS Ka = 10-1 изомерные формы : H - S - C ≡ N
- 58. Тиоциановая кислота HCNS Ka = 10-1 Получение : KCN + S сплавление = KCNS KCNSтверд. +
- 59. Тиоциановая кислота HCNS Ka = 10-1 HCNS хорошо растворяется в воде и походит по свойствам с
- 60. Родан (CNS)2 аналогия : 2KJ + Br2 = J2 + 2KBr 2KCNS + Br2 = (CNS)2
- 61. Родан (CNS)2 Существуют 2 таутомерные формы родана : [ N Ξ C – S – S
- 63. Скачать презентацию

























![Примеры карбонильных комплексов [ Cr(CO)6 ] [ (CO)5Mn – Mn(CO)5 ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/509133/slide-30.jpg)














![Примеры цианидных комплексов [ Ag(CN)3 ] 2- β3 = 1021 [](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/509133/slide-47.jpg)
![Дициан (CN)2 [ N ≡ C – C ≡ N ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/509133/slide-48.jpg)
![Дициан (CN)2 [ N ≡ C – C ≡ N ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/509133/slide-49.jpg)
![Дициан (CN)2 [ N ≡ C – C ≡ N ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/509133/slide-50.jpg)









 Презентация по Химии "Твердые вещества" - скачать смотреть
Презентация по Химии "Твердые вещества" - скачать смотреть  Основания, их состав, номенклатура и основные представители
Основания, их состав, номенклатура и основные представители Композитный материал
Композитный материал Формы кристаллов и агрегаты
Формы кристаллов и агрегаты Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Нуклеиновые кислоты
Нуклеиновые кислоты Реакция Пфитцингера
Реакция Пфитцингера Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Предмет органической химии. Теория строения органических веществ А.М. Бутлерова
Предмет органической химии. Теория строения органических веществ А.М. Бутлерова Топливо и его характеристики
Топливо и его характеристики Анализ лекарственных форм
Анализ лекарственных форм Обмен веществ. Регуляция водно-солевого обмена. (Лекция 5)
Обмен веществ. Регуляция водно-солевого обмена. (Лекция 5) Алхимический период
Алхимический период Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Характеристика растворов. Кислоты, основания, соли в свете теории электролитической диссоциации. Гидролиз солей
Характеристика растворов. Кислоты, основания, соли в свете теории электролитической диссоциации. Гидролиз солей Дифференциальный диагноз анемий
Дифференциальный диагноз анемий Галогены Что это такое ?
Галогены Что это такое ? Химия элементов VIA группы
Химия элементов VIA группы Різноманіття карбонових кислот
Різноманіття карбонових кислот Одноатомні спирти Підготували Учениці 9-Б класу
Одноатомні спирти Підготували Учениці 9-Б класу  Презентация Проверим знания по теме «Кремний»
Презентация Проверим знания по теме «Кремний» Методы определения коэффициентов селективности
Методы определения коэффициентов селективности Моторные масла
Моторные масла Чистые вещества и смеси. Способы разделения смесей. Загадка
Чистые вещества и смеси. Способы разделения смесей. Загадка Золь. Свойства золи
Золь. Свойства золи Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade
Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade Презентация по Химии "Металлы 9 класс" - скачать смотреть
Презентация по Химии "Металлы 9 класс" - скачать смотреть  Строение электронных оболочек атомов
Строение электронных оболочек атомов