Содержание
- 2. Атом азота в азотистой кислоте имеет промежуточную степень окисления +3 в связи с этим он может
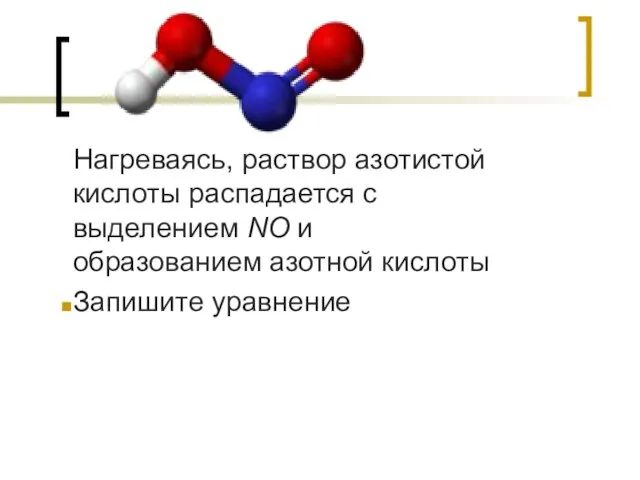
- 3. Нагреваясь, раствор азотистой кислоты распадается с выделением NO и образованием азотной кислоты Запишите уравнение
- 4. Соли азотистой кислоты называются нитритами Нитриты гораздо более устойчивы, чем HNO2, все они токсичны. Представляют собой
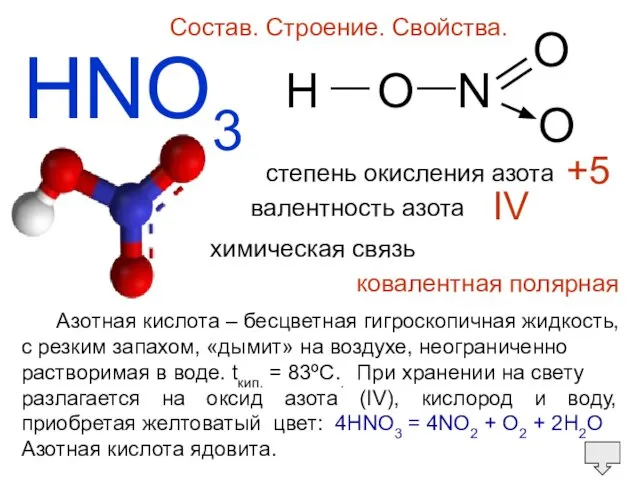
- 5. HNO3 Состав. Строение. Свойства. H O N O O — — степень окисления азота валентность азота
- 6. При разложении азотной кислоты выделяется кислород, поэтому скипидар вспыхивает.
- 7. Азотная кислота (HNO3) Классификация наличию кислорода: основности: растворимости в воде: летучести: степени электролитической диссоциации: кислородсодержащая одноосновная
- 8. Получение азотной кислоты в промышленности NH3 NO NO2 HNO3 4NH3+ 5O2 = 4NO + 6H2O 2NO+O2
- 9. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. Составьте уравнение
- 10. Химические свойства азотной кислоты 1. Типичные свойства кислот 2. Взаимодействие азотной кислоты с металлами 3. Взаимодействие
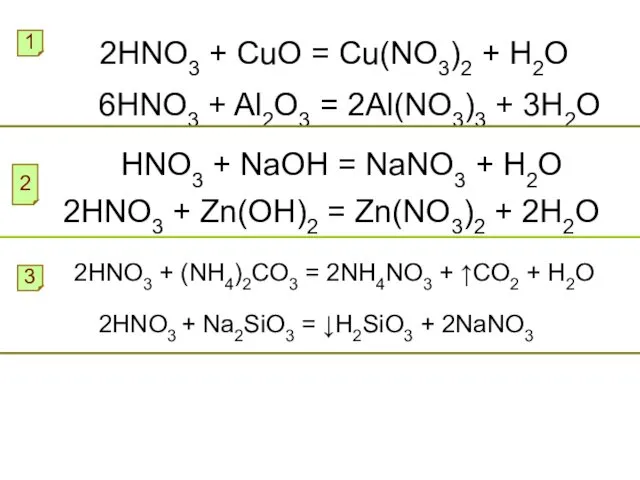
- 11. Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. Перечислите их: Составьте уравнения реакций
- 12. 2HNO3 + CuO = Cu(NO3)2 + H2O 1 6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O HNO3
- 13. Взаимодействие азотной кислоты с металлами Как реагируют металлы с растворами кислот? Металлы, стоящие в ряду активности
- 14. Найти закономерность при взаимодействии азотной кислоты с металлами:
- 15. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее
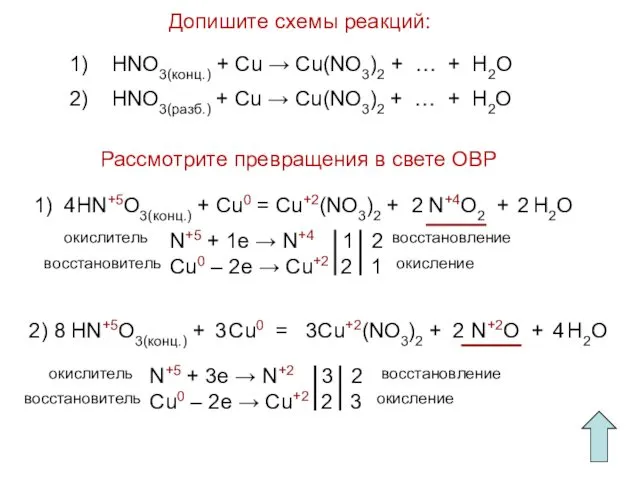
- 16. Допишите схемы реакций: Рассмотрите превращения в свете ОВР 1) HNO3(конц.) + Cu → Cu(NO3)2 + …
- 17. Взаимодействие азотной кислоты с неметаллами Окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается
- 18. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
- 19. Соли азотной кислоты Как называются соли азотной кислоты? нитраты Нитраты K, Na, NH4+ называют селитрами Составьте
- 20. Нитрат калия (калиевая селитра) Бесцветные кристаллы Значительно менее гигроскопична по сравнению с натриевой, поэтому широко применя-ется
- 21. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение
- 22. При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль.
- 24. Скачать презентацию

















 Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Исследование материалов и покрытий методом атомно-силовой микроскопии
Исследование материалов и покрытий методом атомно-силовой микроскопии Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Реакция обменного разложения веществ водой - гидролиз
Реакция обменного разложения веществ водой - гидролиз Пластмассы или пластики
Пластмассы или пластики Презентация по Химии "Интересные факты из жизни великого учёного Дмитрия Ивановича Менделеева." - скачать смотреть бесплатно
Презентация по Химии "Интересные факты из жизни великого учёного Дмитрия Ивановича Менделеева." - скачать смотреть бесплатно Термические превращения углеводородов и других компонентов нефти
Термические превращения углеводородов и других компонентов нефти Твердые тела и их физические свойства
Твердые тела и их физические свойства Периодический закон и строение атома
Периодический закон и строение атома КВН В МИРЕ ВЕЩЕСТВ
КВН В МИРЕ ВЕЩЕСТВ Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Свойства жидких металлов
Свойства жидких металлов Продуктивная экстракция
Продуктивная экстракция Химическая термодинамика биологических процессов
Химическая термодинамика биологических процессов Презентация по Химии "Металлическая связь" - скачать смотреть
Презентация по Химии "Металлическая связь" - скачать смотреть  Свойства растворов
Свойства растворов Обзор разных типов химических связей
Обзор разных типов химических связей Урок-исследование: факторы влияющие на скорость химических реакций
Урок-исследование: факторы влияющие на скорость химических реакций Роль химии в сохранении окружающей среды
Роль химии в сохранении окружающей среды Обобщающее повторение по теме Неметаллы. Урок №7
Обобщающее повторение по теме Неметаллы. Урок №7 Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии
Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии Мини-проект по дисциплине: «Физико-химические методы исследования и техника лабораторных работ»
Мини-проект по дисциплине: «Физико-химические методы исследования и техника лабораторных работ» Химический элемент свинец
Химический элемент свинец Метаболизм углеводов. Регуляция. Нарушения. (Лекция 6)
Метаболизм углеводов. Регуляция. Нарушения. (Лекция 6) Аттестационная работа. Связь химии и жизни на примере красок
Аттестационная работа. Связь химии и жизни на примере красок Основы химической термодинамики
Основы химической термодинамики Презентация по Химии "ФУЛЛЕРЕНЫ И НАНОТРУБКИ" - скачать смотреть бесплатно
Презентация по Химии "ФУЛЛЕРЕНЫ И НАНОТРУБКИ" - скачать смотреть бесплатно Классы неорганических веществ
Классы неорганических веществ