Содержание
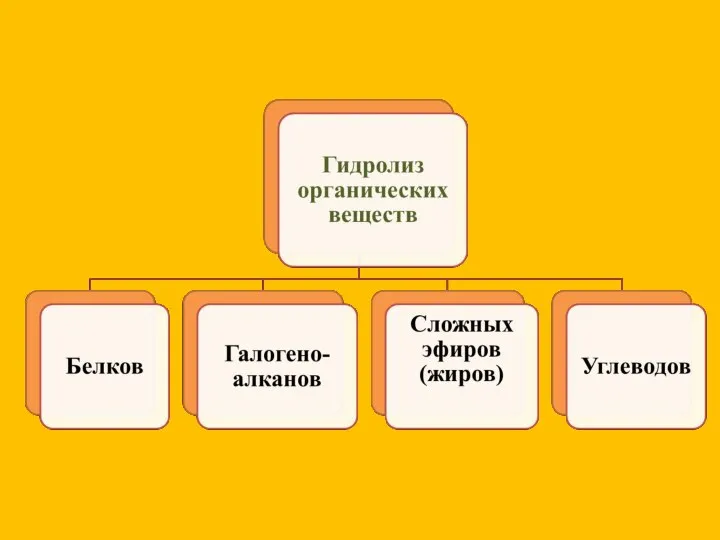
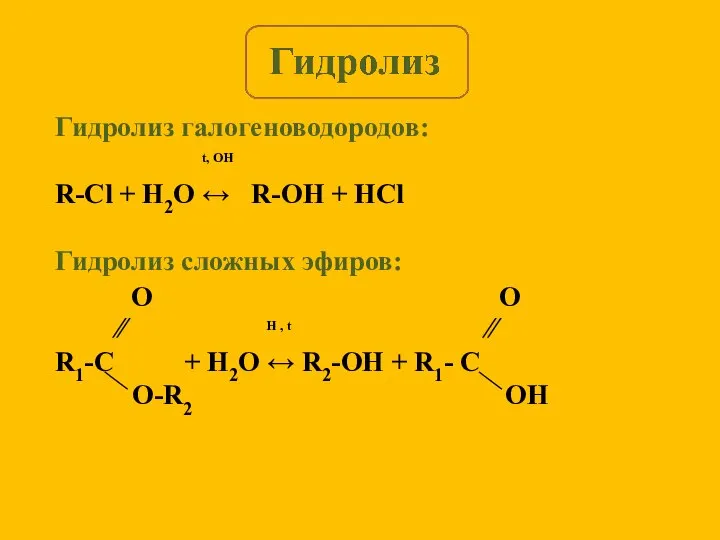
- 4. Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H
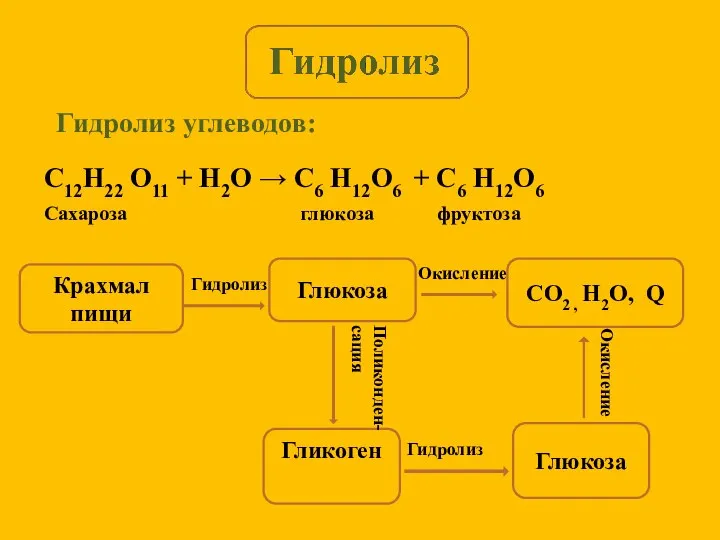
- 5. Гидролиз углеводов: Крахмал пищи Глюкоза CO2 , H2O, Q Гликоген Глюкоза Гидролиз Окисление Поликонден- сация Гидролиз
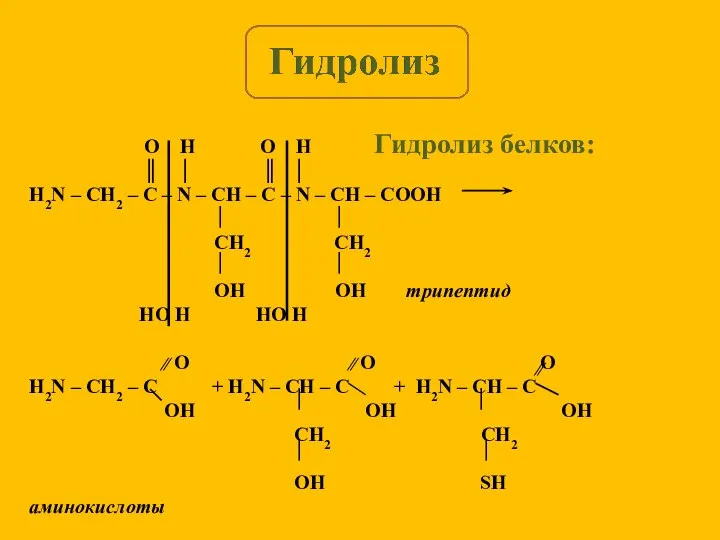
- 6. Гидролиз белков: O H O H ║ │ ║ │ H2N – CH2 – C –
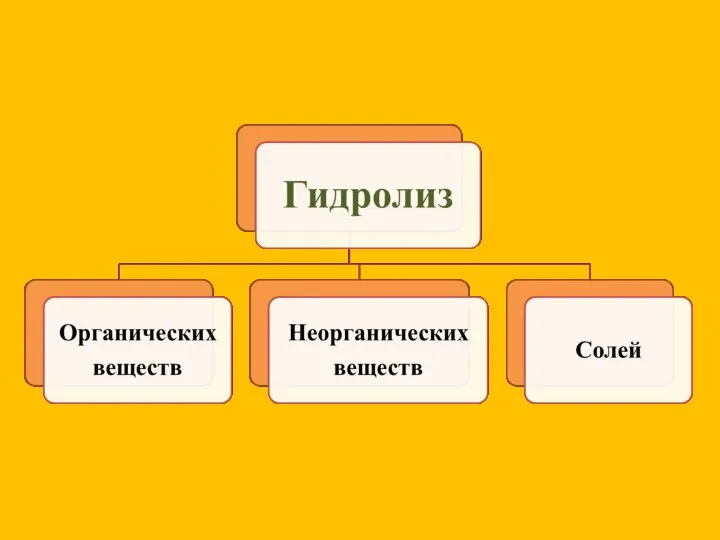
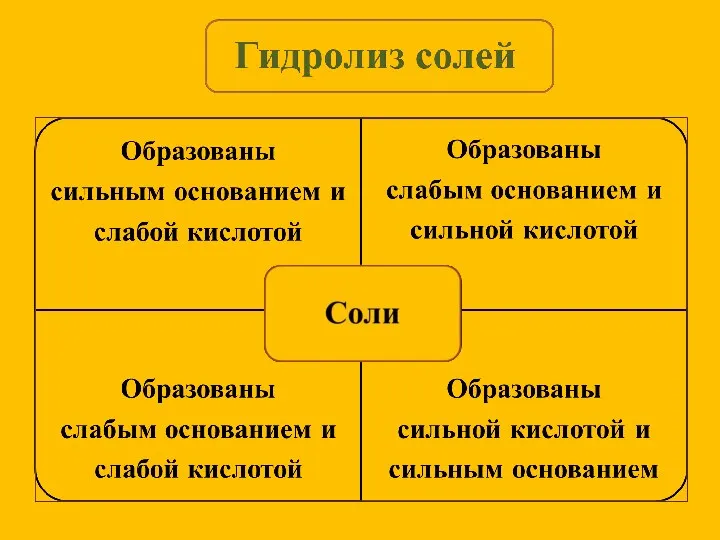
- 7. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате
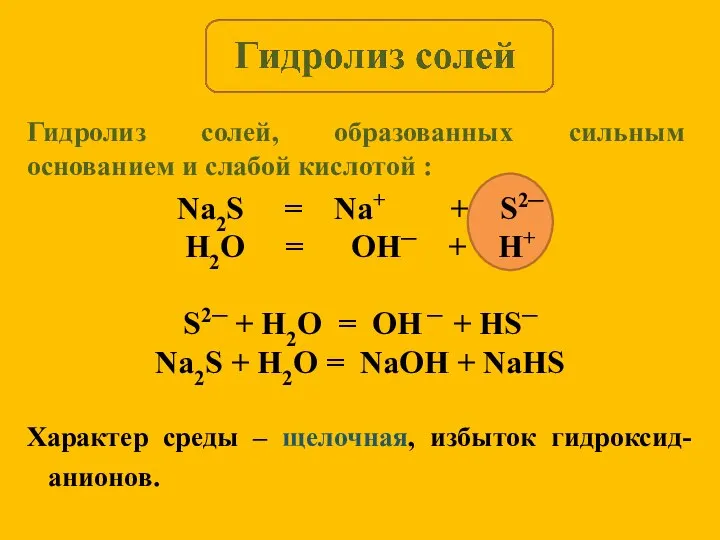
- 9. Na2S = Na+ + S2─ H2O = OH─ + H+ S2─ + H2O = OH ─
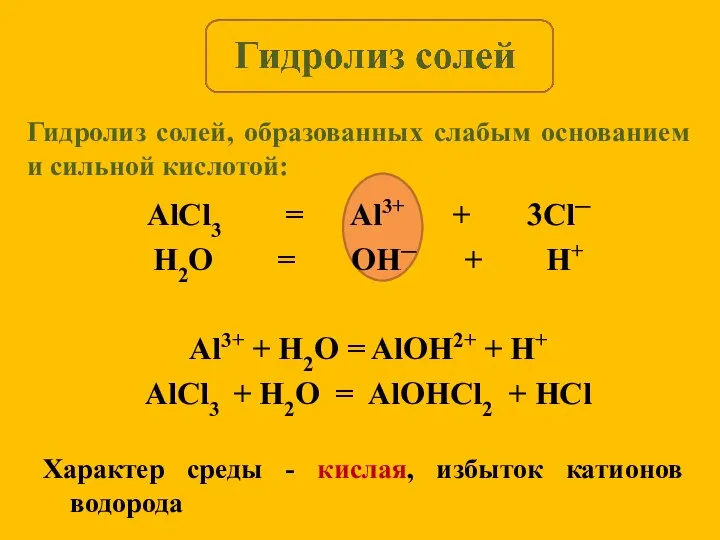
- 10. AlCl3 = Al3+ + 3Cl─ H2O = OH─ + H+ Al3+ + H2O = AlOH2+ +
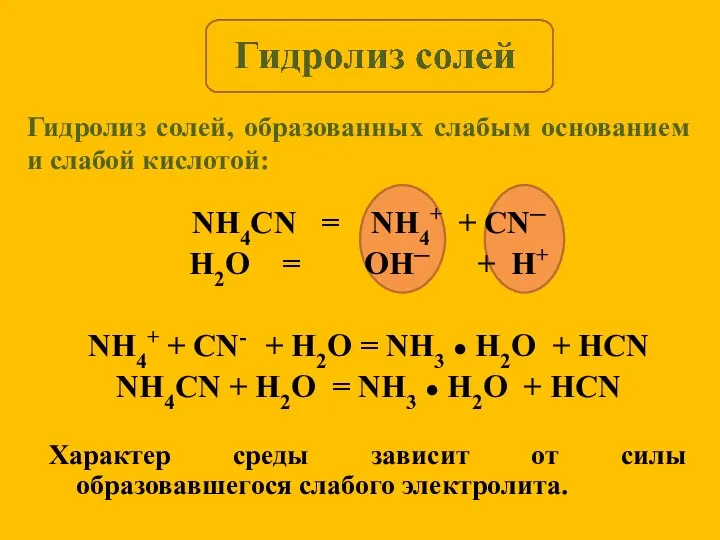
- 11. NH4CN = NH4+ + CN─ H2O = OH─ + H+ NH4+ + CN- + H2O =
- 12. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой: Например, соли, которые нельзя получить реакцией обмена
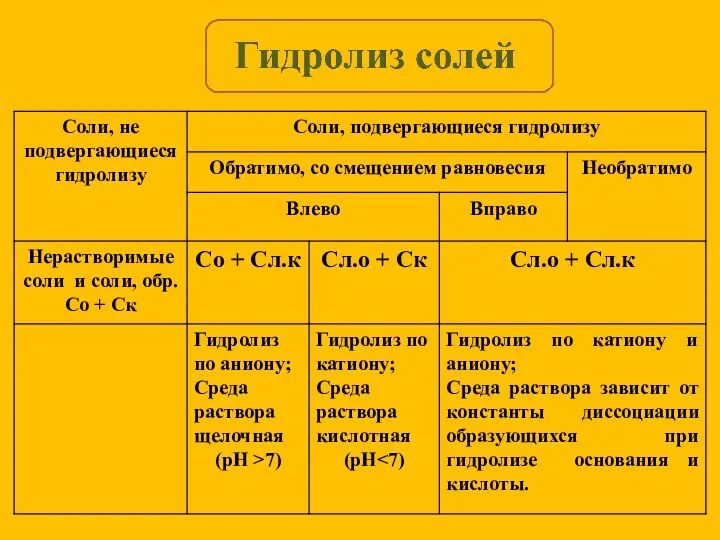
- 13. KCl = K+ + Cl- Слабых ионов нет, гидролиз не идет, среда нейтральная. Гидролиз солей, образованных
- 15. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье). Усилить гидролиз соли можно следующими способами: Добавить
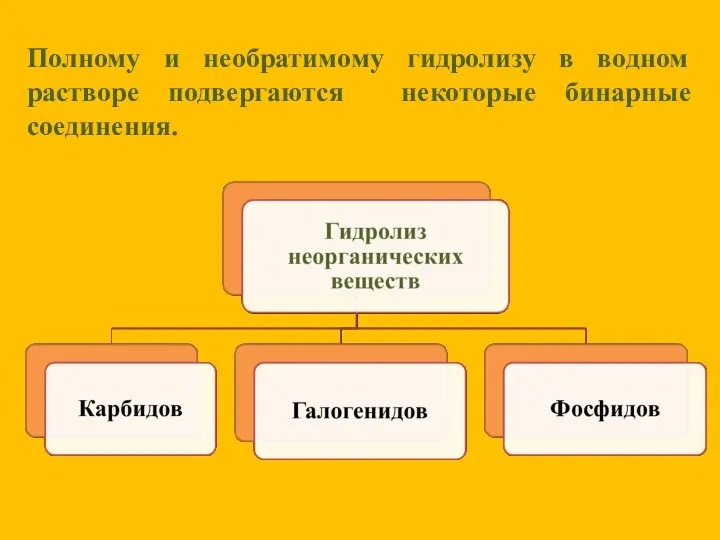
- 16. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.
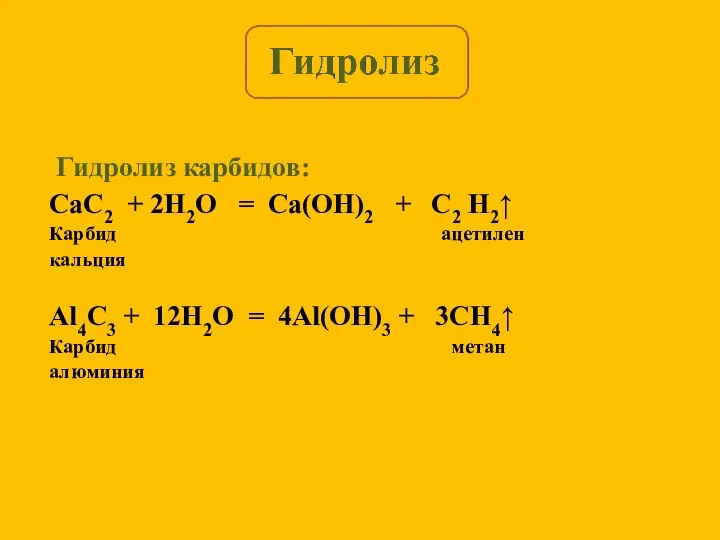
- 17. Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O
- 18. Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов:
- 20. Скачать презентацию





 Аммофос өндірісі. Алыну әдісі
Аммофос өндірісі. Алыну әдісі Универсальные пути катаболизма аминокислот. (Лекция 2)
Универсальные пути катаболизма аминокислот. (Лекция 2) Окислительно-восстановительные реакции. Урок 15
Окислительно-восстановительные реакции. Урок 15 Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Комплексные соединения
Комплексные соединения Фізичні та хімічні властивості води
Фізичні та хімічні властивості води Нітрати в продуктах харчування
Нітрати в продуктах харчування  Radioimmunoassay& enzyme linked immunosorbent
Radioimmunoassay& enzyme linked immunosorbent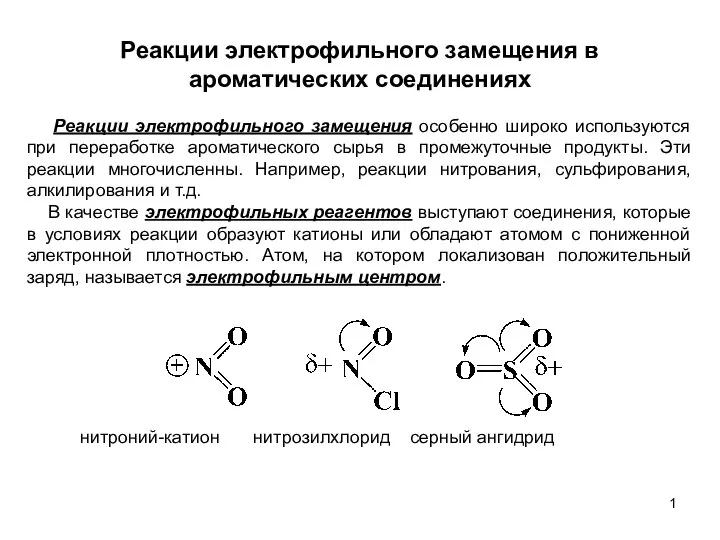 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Презентация по химии Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Презентация по химии Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности 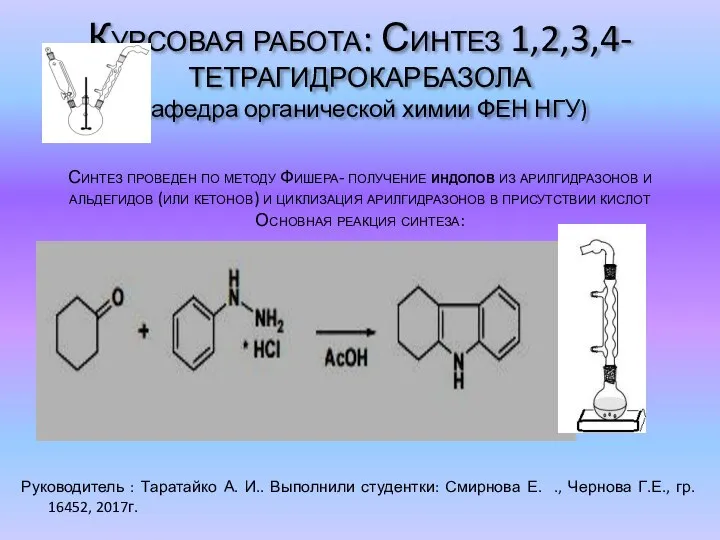 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Неравновесные электрохимические методы. Полярография постоянного тока. Вольтамперометрия. Лекция 2
Неравновесные электрохимические методы. Полярография постоянного тока. Вольтамперометрия. Лекция 2 Плазма та її властивості. Практичне застосування плазми. (11 клас)
Плазма та її властивості. Практичне застосування плазми. (11 клас) Химическая связь и ее виды
Химическая связь и ее виды Правила безпечного використання засобів побутової хімії
Правила безпечного використання засобів побутової хімії  Презентация по Химии "Поширення солей у природі да їх практичне значення" - скачать смотреть
Презентация по Химии "Поширення солей у природі да їх практичне значення" - скачать смотреть  Презентація на тему: Пластмаси. Їх роль у сучасному виробництві.
Презентація на тему: Пластмаси. Їх роль у сучасному виробництві.  Метаболизм белков и аминокислот
Метаболизм белков и аминокислот Алкены. Свойства. 10 класс
Алкены. Свойства. 10 класс Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Фильтрование. Лекция 5
Фильтрование. Лекция 5 Состояние электронов в атомах
Состояние электронов в атомах Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах
Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах Соединения серы (VI)
Соединения серы (VI)  Спирты. Состав и строение спиртов
Спирты. Состав и строение спиртов Диаграмма состояния железо–углерод
Диаграмма состояния железо–углерод Теория химического строения Бутлерова. Второе положение теории Бутлерова. Изомерия. Структурная изомерия
Теория химического строения Бутлерова. Второе положение теории Бутлерова. Изомерия. Структурная изомерия Презентация по Химии "Амиак" - скачать смотреть бесплатно_
Презентация по Химии "Амиак" - скачать смотреть бесплатно_