Содержание
- 2. Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных, высоко-дисперсных систем и ВМС (высоко-молекулярных соединений). Томас Грэм
- 3. ДИСПЕРСНАЯ СИСТЕМА – Дисперсная фаза ( Д.Ф.) - Дисперсионная среда ( Д.С.) -
- 4. Классификация дисперсных систем
- 5. II. По степени дисперсности дисперсной фазы 1. Грубодисперсные системы >10-7 м или >100 нм 2. Коллоидно-дисперсные
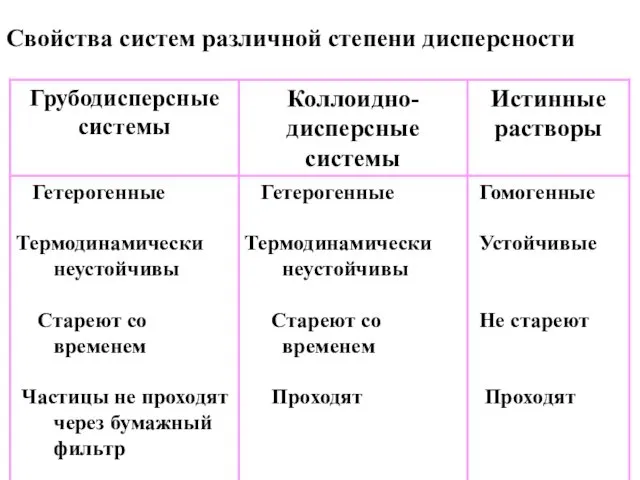
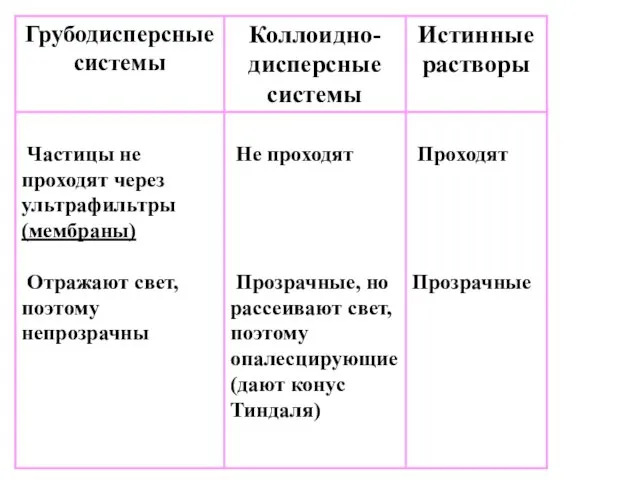
- 6. Свойства систем различной степени дисперсности
- 8. МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ РАСТВОРОВ: I. Методы диспергирования: - механическое дробление; - дробление ультразвуком ; - электрический
- 9. II. Методы конденсации физические методы: а - метод замены растворителя б - метод конденсации паров химические
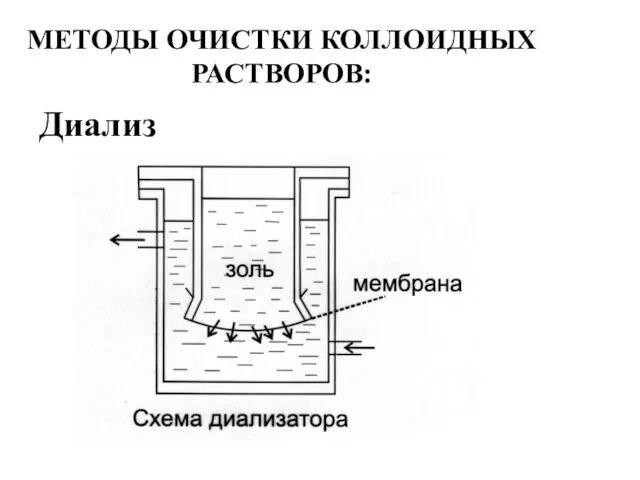
- 10. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ: Диализ
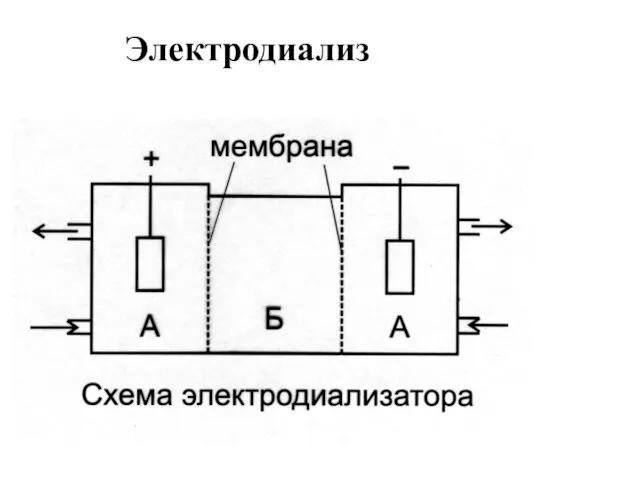
- 11. Электродиализ
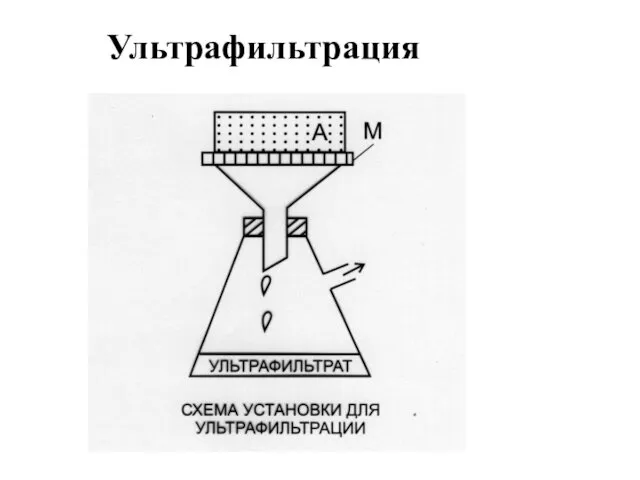
- 12. Ультрафильтрация
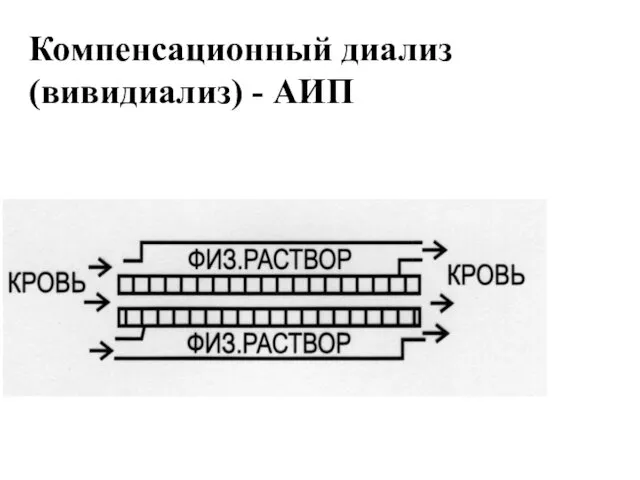
- 13. Компенсационный диализ (вивидиализ) - АИП
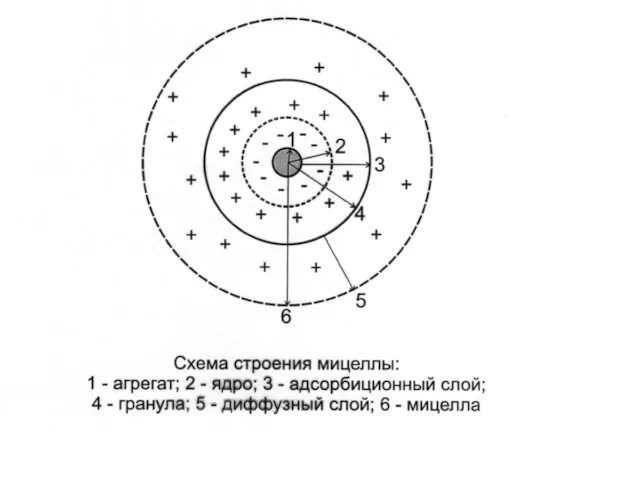
- 14. МИЦЕЛЛА (Лат. Mica -крошка) - это отдельная частица дисперсной фазы коллоидного раствора с жидкой дисперсионной средой.
- 15. Ядро состоит из агрегата (микрокристаллы малорастворимого вещества) и потенциалопределяющих ионов (ПОИ). Мицелла состоит из: 1. ядра;
- 16. Правило ПАНЕТТА-ФАЯНСА: кристаллическую решетку ядра достраивает тот ион, который находится в растворе в избытке и содержится
- 18. Условия получения золя: 1. плохая растворимость Д.Ф. в Д.С., т.е. наличие границы раздела фаз; 2. размер
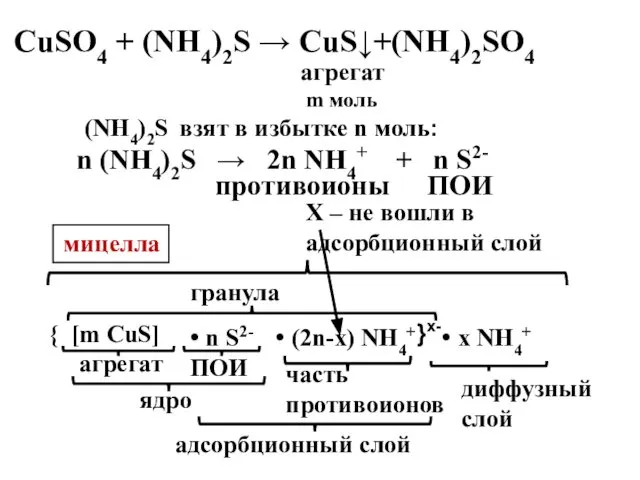
- 19. агрегат m моль (NH4)2S взят в избытке n моль: n (NH4)2S → 2n NH4+ + n
- 20. СuSO4 взят в избытке n моль; n СuSO4 → n Сu2+ + n SO42- противоионы ПОИ
- 21. В мицелле существует 2 скачка потенциала: 1) φ - электротермодинамический – φ ~ 1 В. 2)
- 22. Устойчивость коллоидных растворов: Седиментационная (кинетическая) устойчивость - Критерии: броуновское движение; степень дисперсности; 3. вязкость дисперсионной среды
- 23. II. Агрегативная устойчивость – способность системы противостоять слипанию частиц дисперсной фазы. Критерии: 1. ионная оболочка, т.е.
- 24. Основные факторы устойчивости коллоидных растворов 1. Величина ζ-потенциала 2. Величина электродинамического потенциала (φ) 3. Толщина диффузного
- 25. КОАГУЛЯЦИЯ - процесс укрупнения частиц дисперсной фазы золя с последующим выпадением в осадок. Факторы, вызывающие коагуляцию:
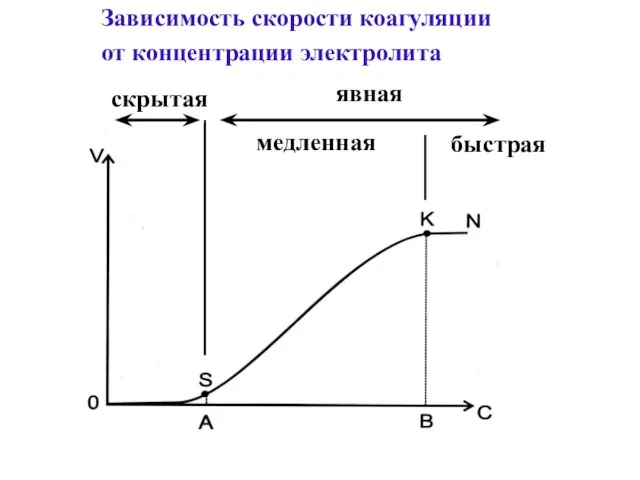
- 26. Зависимость скорости коагуляции от концентрации электролита скрытая явная медленная быстрая
- 27. Порог коагуляции - наименьшее количество электролита, которое вызывает явную коагуляцию 1л золя γ = C· V
- 28. Правило Шульце-Гарди: Для разновалентных ионов их коагулирующее действие прямо пропорционально зарядам ионов в шестой степени
- 29. Р(Al+3) : Р(Ca+2) : Р(K+1) ≈ Гранула ( - ) 36 : 26 : 16 ≈
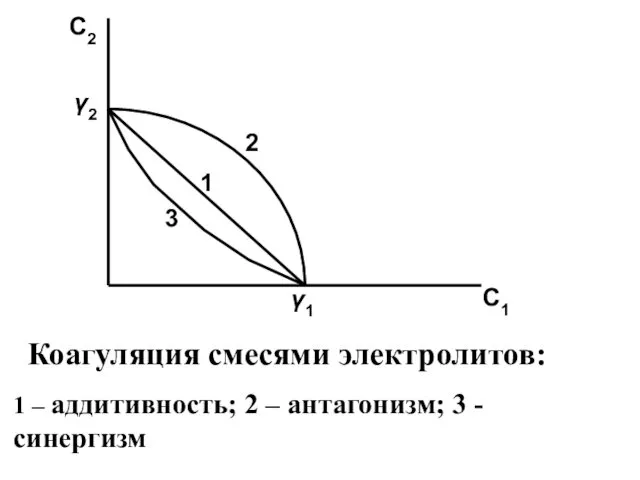
- 30. При коагуляции смесями электролитов возможны 3 случая: 1) аддитивность – 2) антагонизм – 3) синергизм –
- 31. C2 C1 2 1 3 γ2 γ1 Коагуляция смесями электролитов: 1 – аддитивность; 2 – антагонизм;
- 32. Механизм коагуляции золей электролитами 1. Сжатие диффузного слоя 2. Избирательная адсорбция ионов с зарядом, противоположным заряду
- 34. Скачать презентацию





















 Хімічні добавки. Е-числа
Хімічні добавки. Е-числа Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі
Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Пластичний обмін
Пластичний обмін  Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть
Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть  Биохимия нервной ткани. Биологические мембраны
Биохимия нервной ткани. Биологические мембраны амины 10 класс
амины 10 класс Поверхневі явища. Адсорбція
Поверхневі явища. Адсорбція Водородные соединения неметаллов
Водородные соединения неметаллов Аттестационная работа: Сравнение показателей качества меда разных производителей
Аттестационная работа: Сравнение показателей качества меда разных производителей Уравнение температурного режима реактора
Уравнение температурного режима реактора Хімія і медицина
Хімія і медицина  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Окислительно-восстановительные реакции Миронова Елена Анатольевна учитель химии МБОУ СОШ №7 г. Дубна Московской области 2013 го
Окислительно-восстановительные реакции Миронова Елена Анатольевна учитель химии МБОУ СОШ №7 г. Дубна Московской области 2013 го Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Производные фенола: танины
Производные фенола: танины Ферменты (энзимы). (Тема 4)
Ферменты (энзимы). (Тема 4) ПОЧЕМУ СОЛИ СОЛЕНЫЕ ?
ПОЧЕМУ СОЛИ СОЛЕНЫЕ ? Весь курс химии. Кратко
Весь курс химии. Кратко Проект: жило-было мыло
Проект: жило-было мыло Происхождение химических элементов
Происхождение химических элементов Распределительная хроматография
Распределительная хроматография Кислоты и основания
Кислоты и основания Технологии повышения конструкционной прочности сталей
Технологии повышения конструкционной прочности сталей Современные проблемы геологии. Изотопный взгляд на проблему
Современные проблемы геологии. Изотопный взгляд на проблему Гравиметрические методы анализа
Гравиметрические методы анализа Химическая организация клетки
Химическая организация клетки