Содержание
- 2. План Поверхневі явища Поверхнева енергія Поверхневий натяг Правило Дюкло – Траубе Характеристика сорбції Правило Пескова -
- 3. Поверхневі явища Це процеси, які проходять на межі розділення фаз в гетерогенних системах. Властивості молекул в
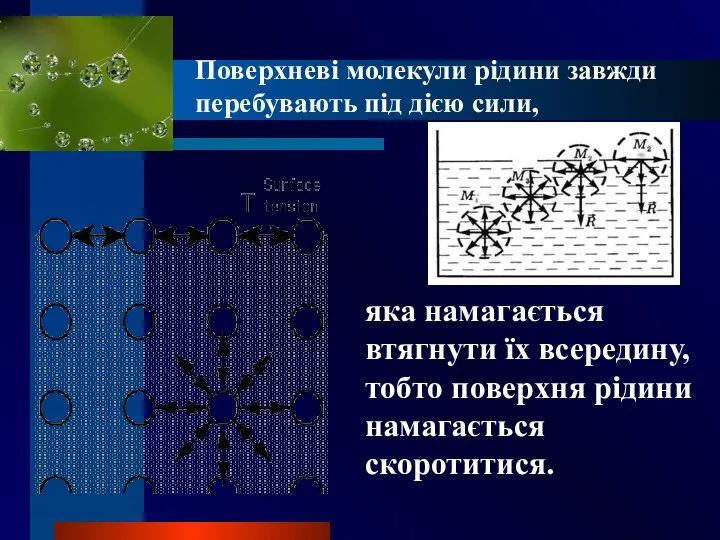
- 4. Поверхневі молекули рідини завжди перебувають під дією сили, яка намагається втягнути їх всередину, тобто поверхня рідини
- 5. Поверхнева енергія Gs Важливою характеристикою поверхневої фази є поверхнева енергія Gs – різниця середньої енергії частинки,
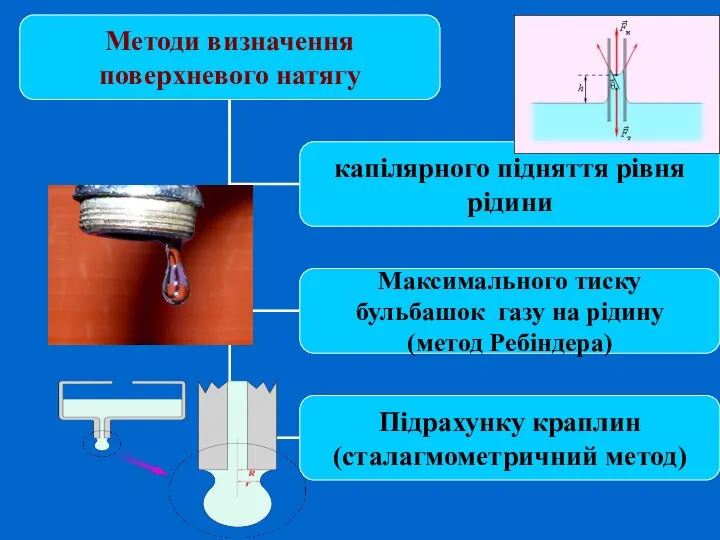
- 6. Поверхневий натяг σ Для характеристики поверхні поділу, що відділяє дану фазу від іншої, вводиться поверхневий натяг
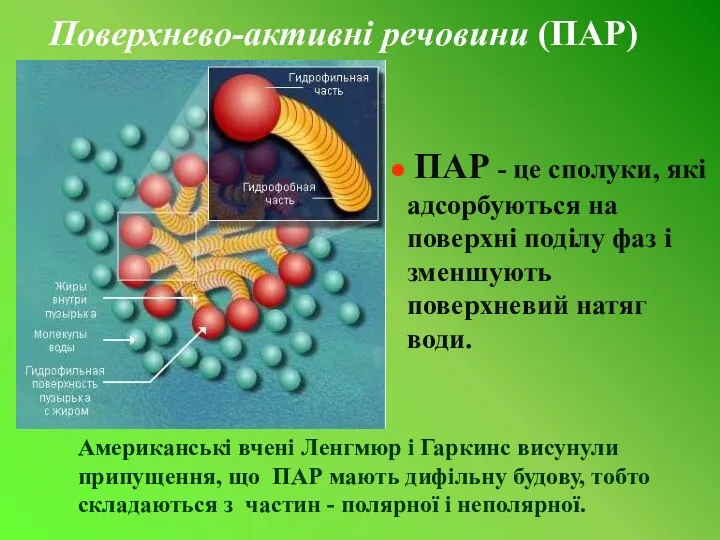
- 8. Поверхнево-активні речовини (ПАР) ПАР - це сполуки, які адсорбуються на поверхні поділу фаз і зменшують поверхневий
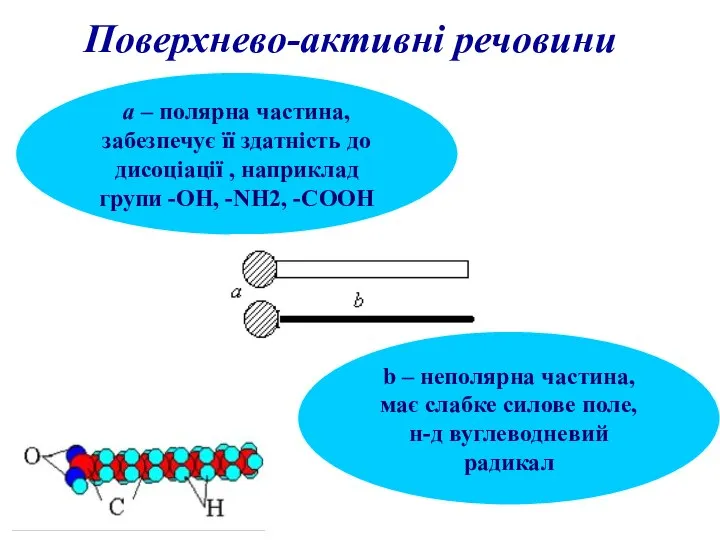
- 9. Поверхнево-активні речовини а – полярна частина, забезпечує її здатність до дисоціації , наприклад групи -ОН, -NH2,
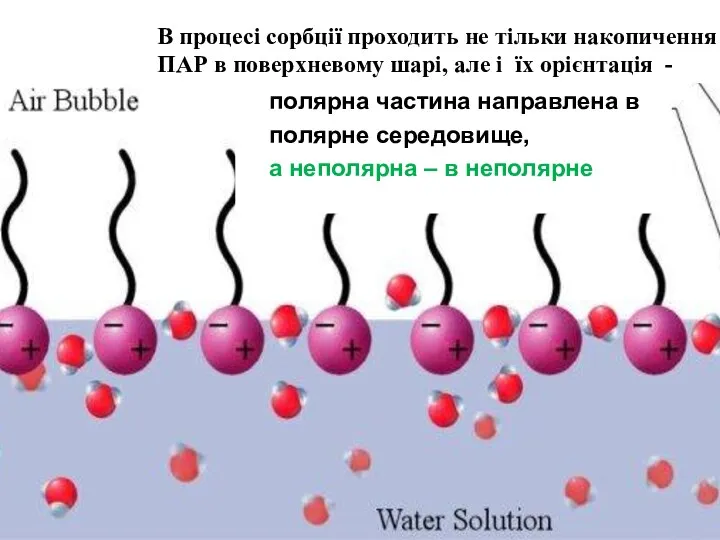
- 10. полярна частина направлена в полярне середовище, а неполярна – в неполярне В процесі сорбції проходить не
- 12. Правило Дюкло -Траубе Поверхнева активність дифільних молекул зі збільшенням вуглецевого ланцюга на одну групу СН2 підвищується
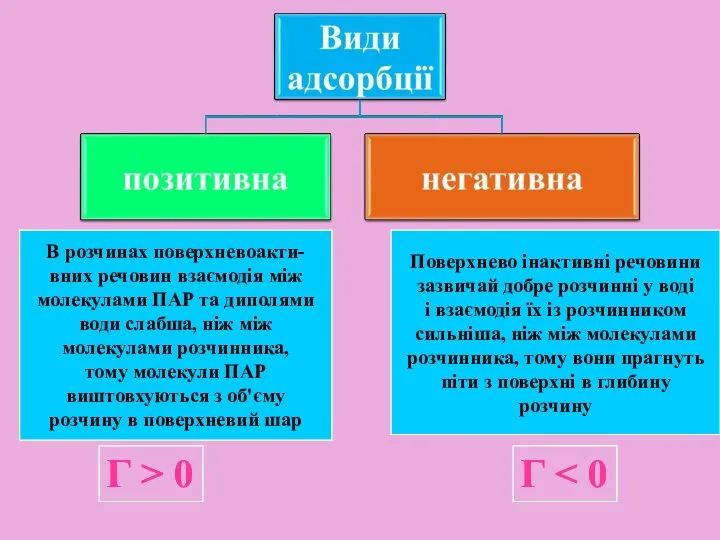
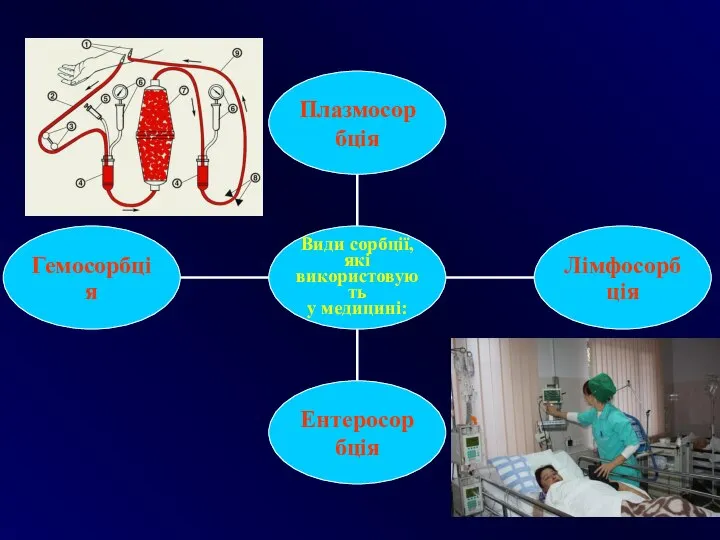
- 13. Характеристика сорбції поглинання однієї речовини іншою речовиною Адсорбція - зміна концентрації компонентів в поверхневому шарі порівняно
- 14. В розчинах поверхневоакти- вних речовин взаємодія між молекулами ПАР та диполями води слабша, ніж між молекулами
- 15. Рівняння Гіббса поверхнева активність Якщо поверхнева активність > 0, тоді адсорбція – негативна, якщо вона
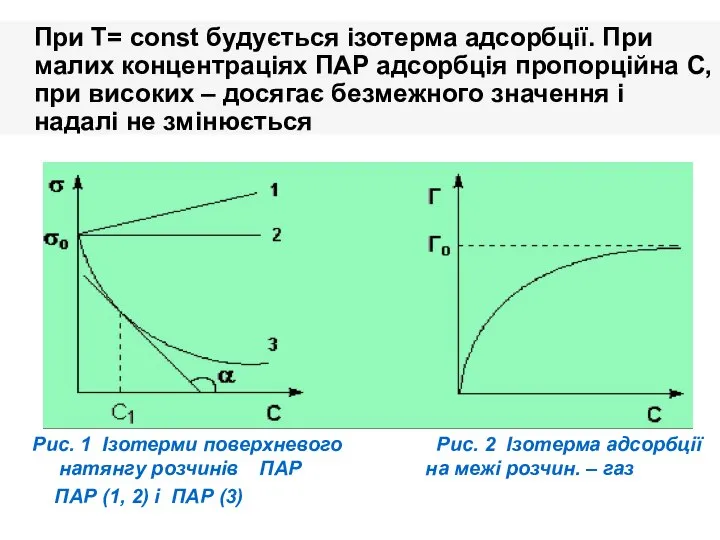
- 16. При T= const будується ізотерма адсорбції. При малих концентраціях ПАР адсорбція пропорційна С,при високих – досягає
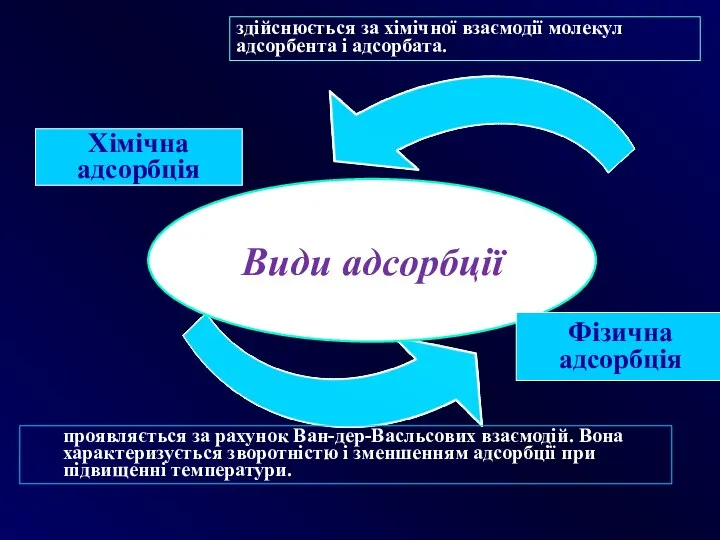
- 17. Хімічна адсорбція здійснюється за хімічної взаємодії молекул адсорбента і адсорбата. проявляється за рахунок Ван-дер-Васльсових взаємодій. Вона
- 18. Адсорбція газів на твердих поверхнях Виражають в молях адсорбтиву на одиницю маси адсорбента: Г = Х
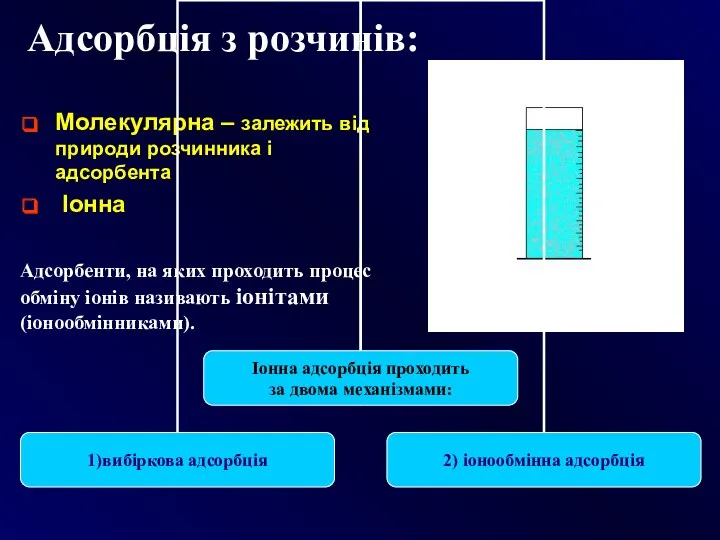
- 19. Адсорбція з розчинів: Молекулярна – залежить від природи розчинника і адсорбента Іонна Адсорбенти, на яких проходить
- 20. Правило вирівнювання полярності фаз (правило Ребіндера): Розчинена речовина тим краще адсорбується , чим більша різниця полярностей
- 21. Правило Пескова-Фаянса або правило вибіркової адсорбції Перше правило. На поверхні кристалічного твердого тіла з розчину електроліту
- 22. Правило Пескова-Фаянса Друге правило. На твердій поверхні адсорбента адсорбуються тільки ті іони, знак заряду яких протилежний
- 24. Хроматографічний метод Окрім свого головного завдання – якісного та кількісного аналізу складних сумішей, – хроматографічні методи
- 25. Залежно від агрегатного стану рухомої фази розрізняють рідинну хроматографію газову хроматографію
- 26. За механізмом розділення є такі види хроматографії: адсорбційна розподільна йонообмінна афінна
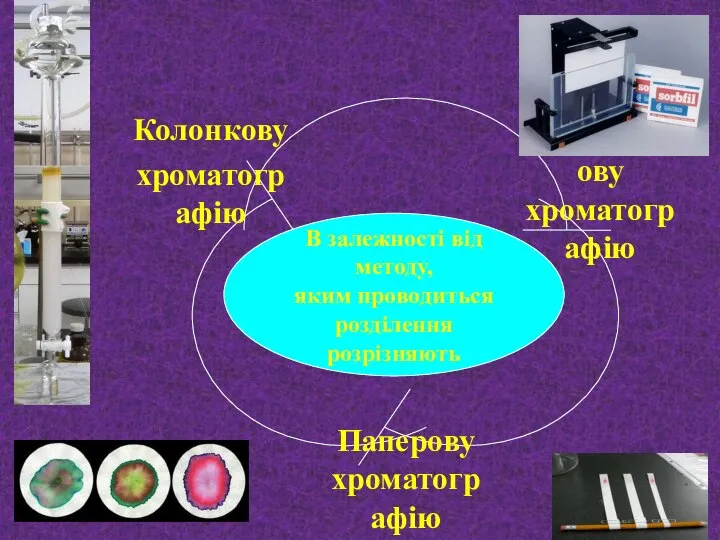
- 27. : В залежності від методу, яким проводиться розділення розрізняють
- 29. Скачать презентацию














 Общая характеристика неметаллов
Общая характеристика неметаллов Розрахунок електронної структури та фізичних властивостей певних структур на основі методів квантової хімії
Розрахунок електронної структури та фізичних властивостей певних структур на основі методів квантової хімії Металлическая связь
Металлическая связь Связывание нейтральных молекул. Клатраты и кавитаты
Связывание нейтральных молекул. Клатраты и кавитаты Углеводы, их классификация и строение Углеводы – это органические вещества, молекулы которых состоят из атомов углерода, водород
Углеводы, их классификация и строение Углеводы – это органические вещества, молекулы которых состоят из атомов углерода, водород Ископаемое топливо
Ископаемое топливо Презентация по Химии "Фосфор" - скачать смотреть бесплатно_
Презентация по Химии "Фосфор" - скачать смотреть бесплатно_ Строение кристаллов
Строение кристаллов Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Дисперсные системы
Дисперсные системы Общая характеристика металлов
Общая характеристика металлов Органическая химия. Химические свойства ацетилена. Применение
Органическая химия. Химические свойства ацетилена. Применение Химия 1 (1)
Химия 1 (1) Химические свойства строительных материалов. Урок №5
Химические свойства строительных материалов. Урок №5 Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Физико - химические основы получения лекарственных препаратов (лекция 6)
Физико - химические основы получения лекарственных препаратов (лекция 6) Тема 3
Тема 3 Дифракционные методы исследований наноматериалов
Дифракционные методы исследований наноматериалов Вдоль по радуге
Вдоль по радуге Органические вещества: липиды
Органические вещества: липиды Химическая промышленность Беларуси
Химическая промышленность Беларуси Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Химический элемент фосфор. Фосфор в составе ДНК и РНК
Химический элемент фосфор. Фосфор в составе ДНК и РНК Оксид серы(VI). Серная кислота
Оксид серы(VI). Серная кислота Поиск и введение в медицинскую практику сульфаниламидных препаратов
Поиск и введение в медицинскую практику сульфаниламидных препаратов Арены и ароматичность
Арены и ароматичность