Содержание
- 2. Тема: Электролитическая диссоциация. Степень и константа диссоциации.
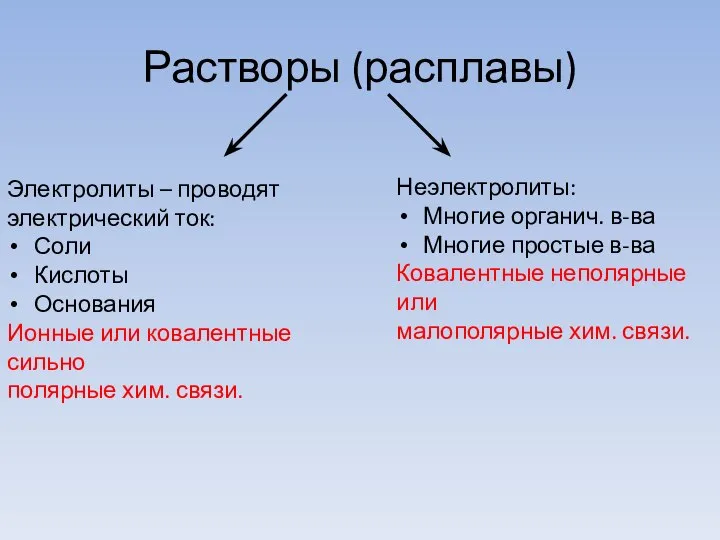
- 3. Растворы (расплавы) Электролиты – проводят электрический ток: Соли Кислоты Основания Ионные или ковалентные сильно полярные хим.
- 4. 2) В растворе или расплаве электролитов оны движутся хаотически. При пропускании через раствор или расплав электрического
- 5. Теория электролитической диссоциации Аррениуса (1887г.) Молекулы электролитов при растворении или расплавлении распадаются на ионы Ионы –
- 7. 3) Диссоциация процесс обратимый.
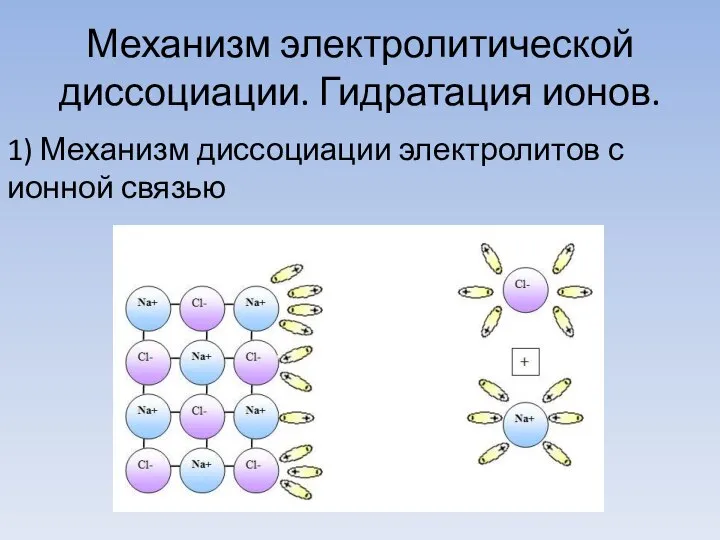
- 8. Механизм электролитической диссоциации. Гидратация ионов. 1) Механизм диссоциации электролитов с ионной связью
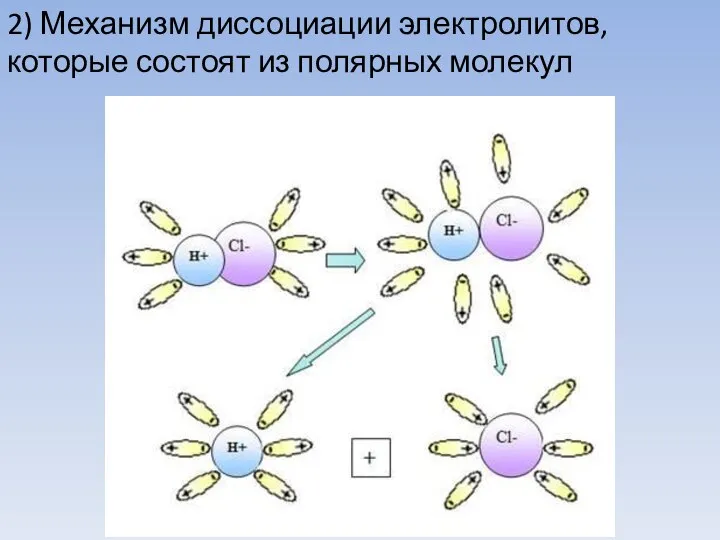
- 9. 2) Механизм диссоциации электролитов, которые состоят из полярных молекул
- 10. Степень диссоциации Степень диссоциации зависит: 1)Природы растворяемого вещества 2) Концентрации раствора 3) Температуры
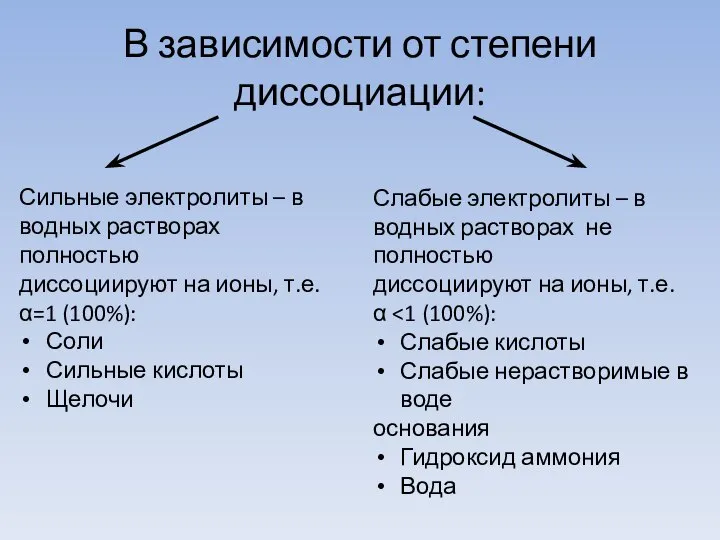
- 11. В зависимости от степени диссоциации: Сильные электролиты – в водных растворах полностью диссоциируют на ионы, т.е.
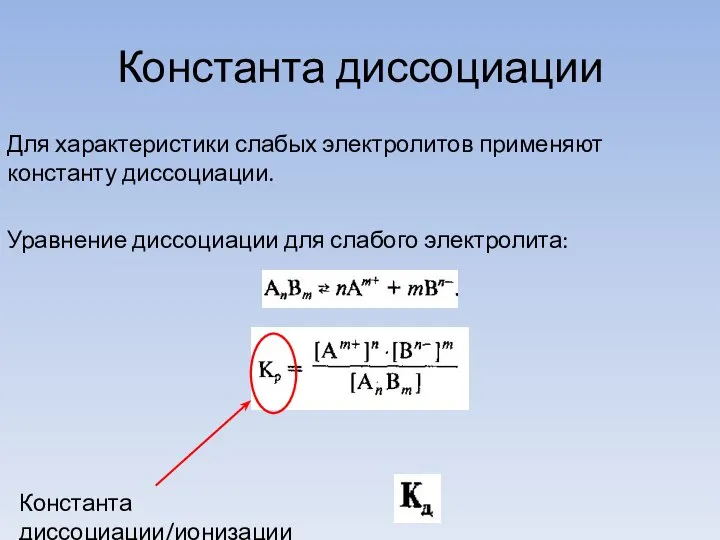
- 13. Константа диссоциации Для характеристики слабых электролитов применяют константу диссоциации. Уравнение диссоциации для слабого электролита: Константа диссоциации/ионизации
- 14. характеризует способность электролита диссоциировать на ионы. Чем больше , тем легче электролит распадается на ионы, тем
- 15. Диссоциация солей, оснований, амфотерных гидроксидов и солей в водных растворах Сильные кислоты Слабые многоосновные кислоты диссоциируют
- 17. Сильные однокислотные Сильные двухкислотные Слабые многокислотные основания диссоциируют ступенчато
- 21. Скачать презентацию













 Амины
Амины Удивительная вода и ее свойства
Удивительная вода и ее свойства Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Скорость химической реакции
Скорость химической реакции Цинк и его соединения
Цинк и его соединения Безопасная помада
Безопасная помада Интеллектуальная викторина по химии для учащихся 8-9 классов
Интеллектуальная викторина по химии для учащихся 8-9 классов Карбоновые кислоты
Карбоновые кислоты Основные концептуальные системы химии
Основные концептуальные системы химии Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы Свойства растворов ВМС
Свойства растворов ВМС Определение гомологического ряда алканов
Определение гомологического ряда алканов Основные понятия органической химии
Основные понятия органической химии Кремний. Получение кремния
Кремний. Получение кремния Электронное строение элементов-органогенов. Типы химической связи
Электронное строение элементов-органогенов. Типы химической связи Гетерофункціональні сполуки. Галогенозамiщенi кислоти
Гетерофункціональні сполуки. Галогенозамiщенi кислоти Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр
Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр Структурная химия и кристаллохимия
Структурная химия и кристаллохимия Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер
Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер Углеводы. Моносахариды, олигосахариды (дисахариды)
Углеводы. Моносахариды, олигосахариды (дисахариды) Нафта. Класифікація нафти
Нафта. Класифікація нафти Диамины
Диамины Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Синтетические красители
Синтетические красители Углехимическое сырьё К нему относят: торф, бурые угли, антрацит, горючие сланцы – ископаемые твердые топлива.
Углехимическое сырьё К нему относят: торф, бурые угли, антрацит, горючие сланцы – ископаемые твердые топлива.  Роль органической химии в жизни человека
Роль органической химии в жизни человека Презентация по Химии "Нефть" - скачать смотреть бесплатно
Презентация по Химии "Нефть" - скачать смотреть бесплатно